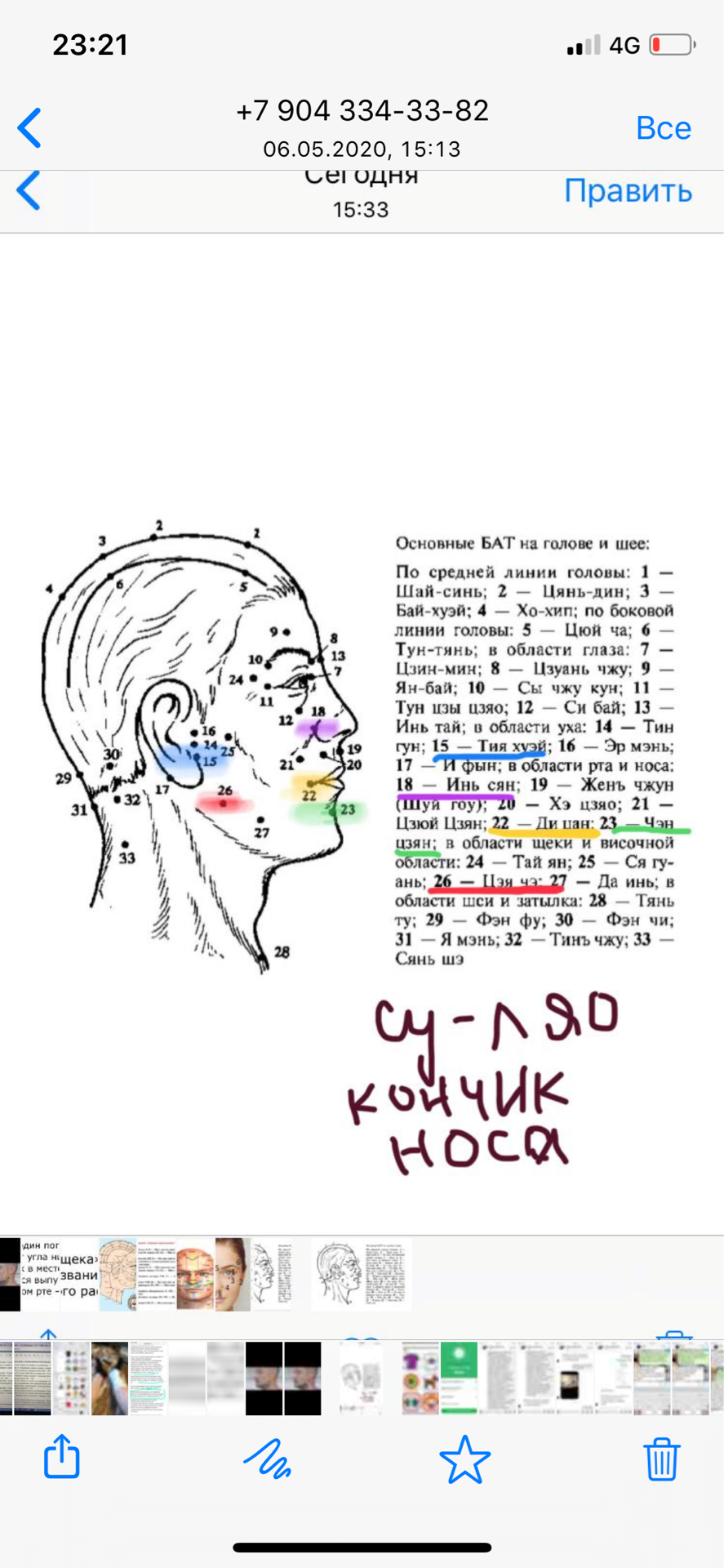
список номер 1
1. Холестерин (CHOLESTEROL) — органическое соединение из класса стероидов. Роль холестерина в организме человека многообразна. Он является строительным материалом для наших клеток и входит в состав клеточных мембран. Он нужен для роста и формирования костей скелета, так как участвует в синтезе витамина D, способствующего удвоению кальция. Без него невозможен синтез половых гормонов. Природа возложила на него роль строителя и созидателя в продолжении рода человеческого.
Значительную долю необходимого холестерина организм вырабатывает сам в тонком кишечнике и печени, а недостающее количество «импортируется» из продуктов питания. Главным поставщиком холестерина являются жирное мясо, желтки куриных яиц, сливочное масло и такие субпродукты, как печень, мозги, почки.
Здоровому человеку рекомендуется употреблять не больше 0,3г холестерина в день. Это количество содержит литр молока, 200г свиного мяса, полтора яйца, 300г отварной курицы, 50г говяжьей печени или 150г копченой колбасы.
Самостоятельно перемещаться в организме человека он не может, путешествуя только с транспортными белками и с жирами. Эти соединения называются липопротеидами. Все они имеют одинаковую форму шара, но различаются по своим размерам, плотности и составу.
Негативная роль холестерина сильнее выражается с возрастом человека. Уровень этого вещества повышается по мере взросления человека, от 1,3–2,6 ммоль/л у новорожденных детей и до 3,9–5,2 ммоль/л у взрослых.
Если кровь взрослого человека содержит свыше 7,8 ммоль/л холестерина, то это свидетельствует о тяжелой гиперхолестеринемии, которая требует лечения.
Надо следить за холестерином, начиная с возраста 20–25 лет, однако если кто-либо из челнов семьи имеет проблемы с высоким уровнем холестерина, то начинать его контролировать должны с подросткового возраста.
Женщин детородного возраста от плохого холестерина защищает сама природа, благодаря женским половым гормонам он не откладывается на стенках сосудов. Однако вследствие менопазуы уровень этого вещества, а вместе с ним и риск сердечно-сосудистых заболеваний, увеличивается.
Помимо этого, холестерин участвует в выработке серотонина, который участвует в процессах передачи нервных импульсов. Если количество образующегося серотонина недостаточно, человеку угрожает депрессия.
2. Триглицериды (Triglyceredes) – это основной энергетический запас человека, именно эти вещества накапливаются в клетках жировой ткани. Организм получает триглицериды с пищей, а также печень синтезирует их из других питательных субстанций, например, углеводов. Когда организм испытывает энергетический голод, он расщепляет триглицериды с выделением воды, глицерина и энергии. Полезная вещь!
Но проблема в том, что, как и холестерин триглицериды циркулируют в крови в виде липопротеидов, при избыточном уровне которых неизбежно «налипание» на стенки сосудов, что объясняет их печальную роль в прогрессировании и формировании атеросклеротических процессов.
Избыточный уровень триглицеридов может быть результатом наследственной предрасположенности, но скорее всего является признаком избыточного приема пищи содержащие животные жиры. Высокий уровень триглицеридов – это настоящий маркер риска.
Допустимые и критические уровни триглицеридов.
приемлемый уровень триглицеридов – ниже 1,7 ммоль/л – низкий риск возникновения сердечно-сосудистых заболеваний,
пограничный уровень триглицеридов – 1,7-2,2 ммоль/л — средний риск развития сердечно-сосудистых заболеваний, требуется постоянный контроль.
высокий уровень триглицеридов – 2,3-5,6 ммоль/л – говорит о большой вероятности развития сердечно-сосудистых заболеваний, требуется профилактическое обращение к врачу и постоянный контроль.
очень высокий уровень триглицеридов – выше 5,6 ммоль/л – помимо высокого риска проблем с сердцем, в этом случае очень велика опасность развития панкреатита, требуется обращение к врачу, назначение препаратов и постоянный контроль.
Неточности при измерении триглицеридов, индивидуальная вариабельность и взаимодействие между триглицеридами и другими липидными показателями могут «затемнять» вклад триглицеридов в развитие ИБС. Однако уровень триглицеридов натощак представляет собой полезный маркер риска ИБС (ишемической болезни сердца), в частности, когда рассматривается уровень ХС ЛПВП. На основании клинических наблюдений и популяционных исследований сделан вывод, что содержание триглицеридов в крови свыше 1,7 ммоль/л (155 мг/дл) является нежелательным, а свыше 2,3 ммоль/л (200 мг/дл) – уже увеличивает риск развития ИБС и требует коррекции. Результаты эпидемиологических исследований в нашей стране демонстрируют, что частота гипертриглицеридемии (>1,7 ммоль/л) составляет среди мужчин среднего возраста 18,0%, а среди женщин – 12,6%. При этом весьма различается возрастное распределение показателя в зависимости от пола. Так, в возрасте от 20 до 50 лет частота гипертриглицеридемии в 2,5 – 3 раза выше среди мужчин по сравнению с женщинами. В более старших возрастных группах распространенность этого показателя среди мужчин практически не изменяется, тогда как среди женщин продолжает расти, достигая 28,5%. Возможно, это связано с более выраженными изменениями других показателей, например уровнем глюкозы, ожирения, которые существенно чаще распространены среди женщин этого возраста. Риск умереть от ИБС у лиц с высокими значениями триглицеридов в 1,5 и 2 раза выше, чем с низкими, соответственно у мужчин и женщин.
3. Альфа-холестерин (HDL a-cholesterol) играет большую роль в утилизации избытка холестериновых молекул. Липопротеины высокой плотности циркулируют в кровеносном русле и там, где отмечается повышенная концентрация неизрасходованного клетками холестерина, связывают его и транспортируют в печень. В гепатоцитах ЛПВП под действием печеночных ферментов освобождаются от ХС, последний выводится из организма с желчью.
Чем выше уровень холестерина-ЛПВП в крови, тем активнее выводится из тканей лишний холестерин, тем меньше вероятность образования атеросклеротических бляшек на сосудистых стенках, тем меньше шансов к развитию сердечнососудистой патологии. Таким образом, холестерин-ЛПВП является «хорошим» или антиатерогенным.
Исследование HDL является обязательным при изучении липидного обмена. Данный анализ назначается также в качестве маркера эффективности немедикаментозной и фармакологической коррекции метаболизма. Норма – не менее 1,5 ммоль/л. Крайнее нижнее значение 1,0.
Контролировать этот показатель обязаны все пациенты, к которым относится любой из ниже перечисленных факторов:
— Возраст старше 40 лет;
— Сидячий или малоподвижный образ жизни;
— Преобладание в рационе питания животных жиров, рафинированных и простых углеводов;
— Курение;
— Частые стрессы;
— Злоупотребление алкоголем;
— Наличие избыточной массы тела;
— Сердечнососудистые болезни у близких родственников;
— Скачки артериального давления, особенно частое его повышение;
— Пограничные значения глюкозы и показателей липидного обмена в биохимической пробе крови.
К патологическому снижению приводит также:
— Почечная недостаточность;
— Генетические дефекты синтеза липопротеиновых компонентов;
— Печеночная патология с хроническим застоем желчи (желчнокаменная болезнь, дискинезия желчно-выводящих протоков, гепатит, цирроз, токсическое поражение печени).
Если у ребенка в семье были случаи повышенного холестерина или заболеваний сердца в молодом возрасте, то впервые липидограмму ему рекомендуется сдавать в возрасте от 2 до 10 лет.
Референсные значения: 0 — 3,3 ммоль/л.
Понятие «норма» не вполне применимо по отношению к уровню ХС ЛПНП. У разных людей, в жизни которых присутствует разное количество факторов риска, норма ЛПНП будет своей. Исследование на ХС ЛПНП используется для определения риска возникновения сердечно-сосудистых заболеваний, однако, чтобы точно определить его для какого-либо человека, необходимо учесть все факторы.
Повышение уровня холестерина ЛПНП может быть результатом наследственной предрасположенности (семейной гиперхолестеролемии) или избыточного приема с пищей животных жиров. У большинства людей с повышенным холестерином в той или иной мере задействованы оба фактора.
Уровень ХС ЛПНП можно оценить следующим образом:
меньше 2,6 ммоль/л – оптимальный,
2,6-3,3 ммоль/л – близок к оптимальному,
3,4-4,1 ммоль/л – погранично высокий,
4,1-4,9 ммоль/л – высокий,
выше 4,9 ммоль/л – очень высокий.
Возможные причины повышения уровня холестерина ЛПНП:
холестаз – застой желчи, который может быть вызван заболеванием печени (гепатитом, циррозом) или камнями в желчном пузыре,
хроническое воспаление почек, приводящее к нефротическому синдрому,
хроническая почечная недостаточность,
снижение функции щитовидной железы (гипотиреоз),
плохо вылеченный сахарный диабет,
алкоголизм,
ожирение,
рак простаты или поджелудочной железы.
Пониженный уровень ХС ЛПНП не используется в диагностике из-за низкой специфичности. Тем не менее его причинами могут быть:
наследственная гипохолестеролемия,
тяжелое заболевание печени,
онкологические заболевания костного мозга,
повышение функции щитовидной железы (гипертиреоз),
воспалительные заболевания суставов,
B12- или фолиеводефицитная анемия,
распространенные ожоги,
острые заболевания, острые инфекции,
хроническая обструктивная болезнь легких.
Что может влиять на результат?
Концентрация холестерина время от времени может изменяться, это нормально. Единичное измерение не всегда отражает обычный уровень, поэтому иногда может потребоваться пересдать анализ через 1-3 месяца.
Повышают уровень холестерина липопротеинов очень низкой плотности ( ХС ЛПОНП):
беременность (липидограмму следует делать по меньшей мере через 6 недель после рождения ребенка),
длительное голодание,
сдача крови стоя,
анаболические стероиды, андрогены, кортикостероиды,
курение,
прием пищи, содержащей животные жиры.
Снижают уровень ХС ЛПОНП:
нахождение в положении лежа,
аллопуринол, клофибрат, колхицин, противогрибковые препараты, статины, холестирамин, эритромицин, эстрогены,
интенсивная физическая нагрузка,
диета с низким содержанием холестерина и насыщенных жирных кислот и, напротив, высоким содержанием полиненасыщенных жирных кислот.
Липидограмму необходимо сдавать, когда человек относительно здоров. После острого заболевания, инфаркта, хирургической операции следует подождать перед измерением холестерола как минимум 6 недель.
ЛПНП, как правило, рассчитывают по следующей формуле: ХС ЛПНП = общий ХС – (ХС ЛПВП – ТГ (триглицериды)/2,2).
В США липиды измеряются в миллиграммах на децилитр, в России и в Европе – в миллимолях на литр. Пересчет осуществляется по формуле ХС (мг/дл) = ХС (ммоль/л) × 38,5 или ХС (ммоль/л) = ХС (мг/дл) х 0,0259.
5. Индекс атерогенности – это отношение «плохого» холестерина к «хорошему», характеризующее риск развития сердечно-сосудистых заболеваний.
Кровь рекомендуется сдавать утром, в период с 8 до 11 часов. Взятие крови производится натощак, спустя 10–12 часов голодания. Допускается употребление воды без газа и сахара. Накануне сдачи исследования следует избегать пищевых перегрузок.
Референсные значения: 0,0–4,0.
Результат выше 4 указывает на преобладание «плохого» холестерина, что может быть признаком атеросклероза.
Для более точной оценки риска развития сердечно-сосудистых заболеваний необходим учет всех факторов: сердечно-сосудистые заболевания у пациента или у его родственников, курение, повышенное артериальное давление, сахарный диабет, ожирение и др.
Понижение Индекса атерогенности не имеет клинического значения.
Индекс атерогенности повышают:
беременность (анализ на холестерин следует сдавать по меньшей мере через 6 недель после рождения ребенка);
длительное голодание;
анаболические стероиды, андрогены, кортикостероиды;
курение;
прием пищи, содержащей животные жиры.
Индекс атерогенности снижают:
аллопуринол, клофибрат, колхицин, противогрибковые препараты, статины, холестирамин, эритромицин, эстрогены;
интенсивная физическая нагрузка;
диета с низким содержанием холестерина и высоким содержанием полиненасыщенных жирных кислот.
Важно!
Анализ на липиды необходимо сдавать, когда человек относительно здоров. После острого заболевания, инфаркта, хирургической операции до проведения липидограммы необходимо подождать как минимум 6 недель.
6. Глюкоза (GlUCOSE) – это простой сахар, который необходим для обеспечения организма энергией. Она образуется при расщеплении углеводов, которые человек употребляет в пищу.
Усвоенная организмом глюкоза поступает в кровь. Ее уровень регулируется при помощи гормонов. В случае нарушения обмена веществ концентрация сахара может существенно отклоняться от нормы, что чревато серьезными проблемами со здоровьем. Анализ крови на глюкозу дает возможность контролировать этот показатель, и при необходимости своевременно принимать меры, чтобы не допустить развития осложнений.
Больным сахарным диабетом данный анализ проводят регулярно.
Глюкоза не только является источником энергии, а так же необходима для регулирования функций нервных клеток и мозга. При недостатке сахара они не способны нормально функционировать.
Использование глюкозы регулируется инсулином. Количество этих двух веществ взаимосвязано между собой по принципу обратной связи. В случае нарушения их баланса уровень сахара повышается или организм испытывает ее недостаток.
В результате развивается гипергликемия. Для недостатка глюкозы характерен повышенный аппетит, немотивированное беспокойство. Возможно нарушение ясности зрения и помутнение сознания.
При повышенном сахаре появляется постоянное чувство жажды, повышенная восприимчивость к инфекционным заболеваниям, утомляемость.
Значительные отклонения уровня сахара от нормы представляют угрозу для жизни. Может нарушиться работа мозга, повреждаются внутренние органы, возможна кома.
7. Гликозилированый Hb (Гликированный гемоглобин (A1c) – специфическое соединение гемоглобина эритроцитов с глюкозой, концентрация которого отражает среднее содержание глюкозы в крови за период около трех месяцев.
Как правильно подготовиться к исследованию?
1. Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
2. Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
3. Не курить в течение 30 минут до исследования.
Анализ на гликированный гемоглобин (A1c) помогает оценить среднее содержание глюкозы в крови за последние 2-3 месяца.
Гемоглобин – это находящийся внутри красных кровяных клеток (эритроцитов) белок, переносящий кислород. Существует несколько типов нормального гемоглобина, кроме того, идентифицировано много аномальных разновидностей, хотя преобладающая форма – это гемоглобин А, составляющий 95-98 % от общего гемоглобина. Гемоглобин А подразделяется на несколько компонентов, один из которых А1с. Часть циркулирующей в крови глюкозы спонтанно связывается с гемоглобином, образуя так называемый гликированный гемоглобин. Чем выше концентрация глюкозы в крови, тем больше образуется гликированного гемоглобина. Соединившись с гемоглобином, глюкоза остается «в связке» с ним до самого конца жизни эритроцита, то есть 120 дней. Соединение глюкозы с гемоглобином А называется HbA1c или A1c. Гликированный гемоглобин образуется в крови и исчезает из нее ежедневно, поскольку старые эритроциты погибают, а молодые (еще не гликированные) занимают их место.
Тест на гемоглобин A1c применяется для контроля за состоянием пациентов, которым поставлен диагноз «сахарный диабет». Он помогает оценить, насколько эффективно идет регулирование уровня глюкозы в процессе лечения.
Некоторым пациентам анализ на гемоглобин A1c назначают для диагностики диабета и преддиабетического состояния дополнительно к тесту на глюкозу в плазме крови натощак и тесту на толерантность к глюкозе.
Пациентам, страдающим диабетом, необходимо стремиться удерживать уровень гликированного гемоглобина не выше 7 %.
В зависимости от типа диабета и от того, насколько хорошо болезнь поддается лечению, тест на А1с проводится от 2 до 4 раз в год. В среднем пациентам с сахарным диабетом рекомендуется сдавать анализ на А1с дважды в год. Если диабет у пациента диагностирован впервые или контрольное измерение прошло неудачно, анализ назначается повторно.
К тому же данный анализ назначается, если у пациента подозревается диабет, поскольку есть симптомы повышенного содержания глюкозы в крови:
сильная жажда,
частое обильное мочеиспускание,
быстрая утомляемость,
ухудшение зрения,
повышенная восприимчивость к инфекциям.
Что означают результаты?
4-6,2 % У пациента нет диабета
6,5 % и больше Пациент болен сахарным диабетом
5,7-6,4 % Преддиабет (нарушение толерантности к глюкозе, связанное с повышенным риском диабета
Что может влиять на результат?
У пациентов с аномальными формами гемоглобина, например у больных с серповидными эритроцитами, уровень гликированного гемоглобина будет занижен. Кроме того, если человек страдает анемией, сильными кровотечениями, результаты анализа у него тоже могут быть заниженными. Напротив, завышенными показатели А1с бывают при недостатке железа и при недавно перенесенном переливании крови (так как жидкие консерванты крови содержат высокую концентрацию глюкозы).
Важные замечания
Анализ на А1с не отражает резкие перепады содержания глюкозы в крови. Колебания глюкозы у пациентов с лабильным диабетом тоже не будут выявлены данным тестом.
8. Азот мочевины (UREA NITROGEN)
Мочевина – один из конечных продуктов белкового метаболизма, содержащий азот. Она продуцируется в печени, переносится кровью в почки, там фильтруется через сосудистый клубочек, а затем выделяется. Результат теста на мочевину в крови является показателем клубочковой продукции и экскреции мочи.
Метаболизированный азот находится в организме в виде аммиака, производимого из остатков распада и переработки белков. Аммиак в печени, соединяясь с углекислым газом, образует мочевину. Быстрое разрушение белков и повреждение почек стремительно поднимают уровень мочевины в крови (так же как и практически любая массивная гибель клеток).
Количество выделяемой мочевины находится в прямой зависимости от уровня потребляемого человеком белка, причинами повышения мочевины в крови являются лихорадочные состояния, осложнения диабета, усиленная гормональная функция надпочечников. Повышенный уровень мочевины – маркер снижения клубочковой фильтрации.
Мочевина – один из основных метаболитов крови, организм никак ее не использует, а только избавляется от нее. Так как этот процесс выделения непрерывный, определенное количество мочевины в норме всегда находится в крови.
Уровень мочевины следует трактовать неотрывно от показателей креатинина. Термин «уремия» применяется, когда уровень мочевины в крови поднимается выше 20 ммоль/л.
Азотемия, показателем которой также служит повышение концентрации мочевины, чаще всего является следствием неадекватной экскреции из-за заболеваний почек.
Уровень мочевины в крови снижается при многих заболеваниях печени. Это происходит из-за неспособности поврежденных клеток печени синтезировать мочевину, что, в свою очередь, ведет к повышению концентрации аммиака в крови и развитию печеночной энцефалопатии.
Почечная недостаточность проявляется при утрате клубочка способности фильтровать через себя метаболиты крови. Это может произойти внезапно (острая почечная недостаточность) в ответ на заболевание, введение лекарств, ядов, повреждение. Иногда это следствие хронических заболеваний почек (пиелонефрита, гломерулонефрита, амилоидоза, опухоли почек и др.) и других органов (диабета, гипертонической болезни и др.).
Анализ на мочевину обычно назначают в комбинации с тестом на уровень креатинина в крови.
Что означают результаты?
Возраст пол Референсные значения
20 — 50 лет мужской 3,2 — 7,3 ммоль/л
женский 2,6 — 6,7 ммоль/л
> 50 лет мужской 3 — 9,2 ммоль/л
женский 3,5 — 7,2 ммоль/л
Причины повышения уровня мочевины в крови:
снижение функции почек, вызванное застойной сердечной недостаточностью, потерей солей и жидкости, шоком в сочетании с чрезмерным катаболизмом белка (желудочно-кишечное кровотечение, острый инфаркт миокарда, стресс, ожоги),
хроническое заболевание почек (пиелонефрит, гломерулонефрит, амилоидоз, туберкулез почек и др.),
обструкция мочевыводящих путей (опухоль мочевого пузыря, аденома простаты, мочекаменная болезнь и др.),
кровотечение из верхних отделов ЖКТ (язвенная болезнь желудка, двенадцатиперстной кишки, рак желудка, двенадцатиперстной кишки и др.),
сахарный диабет с кетоацидозом,
повышенный катаболизм белка при онкологических заболеваниях,
прием кортикостероидов, нефротоксичных лекарственных препаратов, тетрациклинов, избыток тироксина,
применение анаболических стероидов,
питание с высоким содержанием белков (мяса, рыбы, яиц, сыра, творога).
Причины понижения уровня мочевины в крови:
печеночная недостаточность, некоторые заболевания печени: гепатит, цирроз, острая гепатодистрофия, опухоли печени, печеночная кома, отравления гепатотоксичными ядами, передозировки лекарственных средств (при этом нарушается синтез мочевины),
акромегалия (гормональное заболевание, характеризующееся повышенной выработкой соматотропного гормона),
голодание, низкобелковая диета,
нарушение кишечного всасывания (мальабсорбция), например, при целиакии,
нефротический синдром (повышенное выделение белка с мочой, гиперлипидемия, снижение уровня белка в крови),
повышенная выработка антидиуретического гормона (АДГ) и, как следствие, патологическая гиперволемия,
беременность (повышенный синтез белка и увеличение почечной фильтрации вызывают снижение количества мочевины у беременных женщин).
Что может влиять на результат?
У детей и женщин норма мочевины в крови несколько ниже из-за меньшей мышечной массы, чем у мужчин.
Снижение уровня данного показателя происходит при беременности из-за увеличения объема крови.
У пожилых людей уровень мочевины в крови повышен из-за неспособности почек адекватно поддерживать плотность мочи.
Большое количество принимаемых лекарств также влияет на уровень мочевины в крови (особенно его повышают цефалоспорины, цисплатин, аспирин, тетрациклины, тиазидные диуретики).
На уровень мочевины в крови иногда влияет количество белков, потребляемых человеком.
У детей раннего возраста в связи с повышенным синтезом белка уровень мочевины в норме несколько снижен.
9. Креатинин в сыворотке (с определением СКФ) (KREATININ)
Креатинин – это остаточный продукт, получаемый в мышцах при разрушении вещества под названием креатин. Креатин входит в цикл, обеспечивающий организм энергией для сокращения мышц. После 7 секунд интенсивной физической активности креатинфосфат превращается в креатин, затем переходящий в креатинин, фильтрующийся в почках и выделяющийся с мочой. Креатин и креатинин стабильно продуцируются нашим телом в постоянном количестве. Почти весь креатинин выделяется почками, поэтому его концентрация в крови является хорошим показателем их функции. Количество продуцируемого креатинина зависит от общей массы тела и, в частности, мышечной массы. Поэтому, например, уровни креатинина у мужчин будут значительно выше, чем у женщин и детей.
Его незначительная часть (15 %) секретируется канальцами, но в основном он производится благодаря фильтрации в клубочках. Уровень креатинина в крови не выходит за рамки нормы до тех пор, пока клубочковая фильтрация не снизится до критических значений, в особенности у пациентов с низкой мышечной массой. Затем уровень креатинина повышается.
Именно из-за большого количества составляющих (мышечная масса, пол, возраст), влияющих на концентрацию креатинина в крови, это исследование не самый лучший скрининг-тест для выявления почечной недостаточности. В то же время креатинин является более чувствительным индикатором заболеваний почек, чем мочевина.
Что означают результаты?
Референсные значения (норма креатинина):
< 1 мес. — 21 — 75 мкмоль/л
1 — 12 мес. — 15 — 37 мкмоль/л
1 — 3 года — 21 — 36 мкмоль/л
3 — 5 лет — 27 — 42 мкмоль/л
5 — 7 лет — 28 — 52 мкмоль/л
7 — 9 лет — 35 — 53 мкмоль/л
9 — 11 лет — 34 — 65 мкмоль/л
11 — 13 лет — 46 — 70 мкмоль/л
13 — 15 лет — 50 — 77 мкмоль/л
> 15 лет — мужской — 62 — 106 мкмоль/л
> 15 лет — женский — 44 — 80 мкмоль/л
Причины повышения уровня креатинина
Острая и хроническая почечная недостаточность (амилоидоз, поражение почек при сахарном диабете и т. д.).
Недостаточность сердечно-сосудистой системы (инфаркт миокарда, кардиогенный шок, миокардистрофия и т. д.).
Массивное разрушение мышечной ткани (краш-синдром) и выход креатинина из клеток.
Ожоги (массивный некроз клеток с выходом их содержимого в межклеточное вещество).
Акромегалия.
Гигантизм.
Гипертиреоз.
Обезвоживание (сгущение крови и относительная гиперкреатининемия).
Чрезмерные физические нагрузки.
Избыточное потребление мясных продуктов.
Лучевая болезнь.
Обструкция мочевыводящих путей.
Прием нефротоксических препаратов (соединений ртути, сульфаниламидов, тиазидов, антибиотиков из группы аминогликозидов, цефалоспоринов и тетрациклина, барбитуратов, салицилатов, андрогенов, циметидина, триметоприм-сульфаметоксазола).
Повреждение сосудов клубочкового аппарата почек (гломерулонефрит), которое может быть следствием инфекционного или аутоиммунного заболевания.
Бактериальная инфекция почек (пиелонефрит).
Некроз эпителия канальцев (острый тубулярный некроз), вызванный, например, лекарственными средствами или токсинами.
Заболевания простаты, нефролитиаз или другие факторы, вызывающие обструкцию мочевыводящей системы.
Снижение кровотока в почках из-за шока, дегидратации, острой сердечной недостаточности, атеросклероза или осложнений диабета.
Причины снижения уровня креатинина
Голодание.
Гипергидратация (разведение крови – относительная гипокреатининемия).
Атрофия мышц.
Что может влиять на результат?
Факторы, искажающие результат
Беременность (особенно I и II триместры).
Факторы, повышающие результат
Избыточная мышечная масса, как, например, у некоторых атлетов (возможно повышение уровня креатинина, несмотря на нормальную функцию почек).
Увеличенная концентрация в крови некоторых эндогенных метаболитов: глюкозы, фруктозы, кетоновых тел, мочевины.
Применение лекарственных препаратов: аскорбиновой кислоты, леводопы, цефазолина, цефаклора, резерпина, нитрофуразона, ибупрофена, барбитуратов, клонидина, канамицина.
Обширная мышечная травма.
10. Общий билирубин (TOTAL BILIRUBIN) Данный тест предназначен для количественного определения содержания общего (прямого + непрямого) билирубина в сыворотке крови.
Билирубин – это продукт распада гемоглобина. Он имеет интенсивный желто-коричневый цвет. В связи с этим сам билирубин и продукты его метаболизма придают желчи, калу и моче соответствующую окраску.
Гемоглобин – основная часть эритроцитов (красных клеток крови). Его функция состоит в доставке кислорода в ткани из органов дыхания и обратном транспорте углекислого газа. Необходимость в расщеплении гемоглобина и удалении продуктов его распада возникает в связи с процессом постоянного обновления эритроцитов в крови. Красные клетки крови имеют ограниченную продолжительность жизни, которая составляет в среднем 90-150 дней. Эритроциты со сниженной жизнеспособностью распознаются клетками ретикулоэндотелиальной системы, поглощаются ими и распадаются на ферменты. Ретикулоэндотелиальная система представляет собой особые ткани, находящиеся в различных отделах организма и выполняющих иммунную функцию. Органами их особой концентрации являются селезенка, лимфатические узлы и костный мозг. В результате расщепления гемоглобина образуется непрямой (несвязанный) билирубин, который затем выделяется в циркулирующую кровь. За сутки у человека распадается около 1 % циркулирующих эритроцитов с образованием 100-250 мг билирубина.
Следующий этап трансформации билирубина происходит в печени. Клетки печени «захватывают» его из крови, связывают с другим метаболическим компонентом (глюкуроновой кислотой) и превращают в прямой, или связанный, билирубин. Присоединенная глюкуроновая кислота придает билирубину свойство растворяться в жидкости, что и позволяет ему растворяться в желчи, после чего в ее составе он сначала выводится в кишечник, а затем удаляется оттуда вместе с калом.
В крови должно находиться только небольшое количество непрямого билирубина, что соответствует нормальному процессу транспортировки этого вещества из мест его образования (ретикуло-эндотелиальной системы) в печень. Однако на некоторых этапах метаболизма билирубина могут происходить нарушения обмена, при которых его концентрация в сыворотке увеличивается. Это называется гипербилирубинемией (превышение уровня билирубина в крови). Если билирубина в крови слишком много, он может проникнуть из кровяного русла в окружающие ткани, что приведет к симптомам желтухи: желтому оттенку кожи, склер и видимых слизистых оболочек.
Референсные значения (норма билирубина у новорождённых и пациентов других возрастных групп):
Меньше 1 дня ——- 24 — 149 мкмоль/л
1-3 дня ——————58 — 197 мкмоль/л
3-6 дней —————-26 — 205 мкмоль/л
Больше 6 дней———0 — 21 мкмоль/л
Повышение билирубина в крови обычно указывает на преждевременное разрушение эритроцитов, повреждение печеночных клеток или нарушение оттока желчи по желчевыводящим путям. Понижение уровня билирубина не имеет существенного диагностического значения.
Причины повышения уровня общего билирубина в сыворотке:
серповидно-клеточная анемия,
сфероцитоз,
сидеробластная/пернициозная анемия,
физиологическая/гемолитическая желтуха новорождённых,
отравление некоторыми токсическими веществами,
воспаление желчного пузыря и желчевыводящих путей,
желчнокаменная болезнь,
опухоли желчного пузыря,
вирусный/алкогольный/токсический гепатит,
цирроз печени,
метастазы опухоли в печень,
некоторые редкие заболевания крови и нарушения обмена веществ.
11. Прямой билирубин (DIRECT BILIRUBIN)
Билирубин – оранжево-желтый пигмент, обнаруживаемый в желчи и придающий ей характерный цвет. В норме эритроциты циркулируют в крови около 120 дней, а затем разрушаются. Во время их разрушения содержащийся в них гемоглобин (красный пигмент, который переносит кислород от легких к тканям) превращается в непрямой (несвязанный, неконъюгированный) билирубин. Ежедневно в норме образуется около 250-350 мг билирубина, из которых 85 % получается из разрушенных эритроцитов, а остальное количество – из костного мозга и печени.
Непрямой билирубин доставляется в печень, где к нему присоединяется сахаросодержащее вещество, что делает его растворимым в воде. Именно такой билирубин называется прямым (связанным, конъюгированным). Прямой билирубин из клеток печени перемещается в желчные протоки и с желчью переносится в кишечник. Под действием нормальной микрофлоры кишечника сахаросодержащее вещество отщепляется от билирубина, а он сам превращается в коричневый пигмент, придающий характерный цвет калу, который затем выводится из организма.
В норме прямой билирубин почти не содержится в крови. Его концентрация увеличивается в случаях, когда печень способна метаболизировать билирубин, но не может его своевременно вывести. Чаще всего такое бывает из-за закупорки желчных протоков (тогда будет повышаться в основном только прямой билирубин), а также из-за повреждения структуры печени при гепатитах или циррозе (тогда будут повышаться и прямой, и непрямой билирубины).
При препятствии оттоку желчи билирубин не попадает в кишечник и, соответственно, не превращается в коричневый пигмент, поэтому происходит осветление кала. Избыточные количества прямого билирубина, проникая в мочу, начинают придавать ей темный цвет.
Референсные значения (норма прямого билирубина): 0 — 5 мкмоль/л.
Причины повышения уровня прямого билирубина
Подпеченочная (механическая, обтурационная) желтуха – возникает из-за затруднения его оттока (либо внутри печени, либо в других местах по ходу желчевыводящих путей). В этих ситуациях увеличение содержания общего билирубина в основном происходит именно за счет прямого билирубина. Это может быть вызвано камнями желчных протоков, рубцами желчных протоков после хирургических вмешательств, опухолями желчных протоков, раком головки поджелудочной железы, раком желудка при механическом сдавливании общего желчного протока, через который желчь попадает в двенадцатиперстную кишку.
Печеночная (паренхиматозная) желтуха – повышение билирубина из-за повреждения печени. Так как часть билирубина подвергается трансформации, в крови обнаруживается и прямой, и непрямой билирубин. Это может быть вызвано вирусным/алкогольным/токсическим гепатитом, циррозом печени на ранних стадиях, инфекционным мононуклеозом, гепатоцеллюлярным раком или метастазами рака других органов на поздней стадии.
Синдромы Ротора и Дабина – Джонсона – редкие наследственные заболевания, связанные с затруднением выведения прямого билирубина из печеночной клетки.
Причины понижения уровня прямого билирубина:
Прием алкоголя, барбитуратов, кофеина, преднизолона, пенициллина.
12. Непрямой билирубин (UNDIRECT BILIRUBIN)
Несвязанный (непрямой) билирубин является жёлчным пигментом, образуемым в момент распада гемоглобина и разрушения эритроцитов. В отличие от связанного (прямого) билирубина — этот пигмент не растворяется в воде и достаточно токсичен за счёт возможности легко проникать в клетки и нарушать их жизнедеятельность.
Эритроциты (красные кровяные тельца) образуются в красном костном мозге. После повреждения или достигнув старости, они подвергаются разрушению макрофагами в ретикуло-эндотелиальной системе (в частности, в красной пульпе селезёнки). Из эритроцитов освобождается гемоглобин, который затем распадается на молекулу гема и глобиновые цепи, далее расщепляющиеся на аминокислоты. Под действием ферментов гем превращается в непрямой билирубин. Из-за внутримолекулярных водородных связей, непрямой билирубин нерастворим в воде. При этом он растворим в липидах и легко проникает в клеточные мембраны, нарушая метаболические процессы в клетках, что определяет его токсичность. Связываясь с альбуминами крови, непрямой билирубин транспортируется в печень.
Повышение уровня непрямого билирубина
Повышение непрямого билирубина происходит при усиленном распаде эритроцитов — гемолитические анемии, В12-дефицитные анемии, талассемия, обширные гематомы.
Понижение уровня непрямого билирубина
Увеличение непрямого билирубина нередко наблюдается у новорождённых в первые 3 дня жизни. Физиологическая желтуха связана с повышенным распадом эритроцитов с фетальным гемоглобином и недостаточной зрелостью ферментных систем печени. При затянувшейся желтухе у новорождённых необходимо исключать гемолитическую болезнь и врожденную патологию печени и желчевыводящих путей. При конфликте групп крови матери и ребенка возникает повышенный распад эритроцитов малыша, что приводит к повышению непрямого билирубина. Неконъюгированный билирубин обладает токсическим действием на клетки нервной системы и может привести к повреждению головного мозга новорожденного. Гемолитическая болезнь новорождённых требует немедленного лечения.
Показания:
заболевания печени;
холестаз;
дифференциальная диагностика желтух различной этиологии.
Подготовка
Кровь рекомендуется сдавать утром, в период с 8 до 12 часов. Взятие крови производится натощак, спустя 6–8 часов голодания. Допускается употребление воды без газа и сахара. Накануне сдачи исследования следует избегать пищевых перегрузок.
Референсные значения: 0–7,9 мкмоль/л.
13. Общий белок (TOTAL PROTEIN)
Общее содержание белка в сыворотке крови отражает состояние белкового обмена.
Белки преобладают в составе плотного остатка сыворотки крови (жидкой части, не содержащей клеточных элементов). Они служат основным строительным материалом для всех клеток и тканей тела. Из белков построены ферменты, многие гормоны, антитела и факторы свертывания крови. Помимо этого, они выполняют функцию переносчиков гормонов, витаминов, минералов, жироподобных субстанций и других компонентов обмена веществ в крови, а также обеспечивают их транспортировку внутрь клеток. От количества белков в сыворотке зависит осмотическое давление крови, благодаря которому поддерживается баланс между содержанием воды в тканях тела и внутри сосудистого русла. Оно определяет способность воды удерживаться в составе циркулирующей крови и поддерживать упругость тканей. Белки также ответственны за обеспечение правильного кислотно-щелочного равновесия (рН). Наконец, это источник энергии при недоедании или голодании.
Белки сыворотки крови делятся на два класса: альбумины и глобулины. Альбумины синтезируются в печени из пищи. Их количество в плазме влияет на уровень осмотического давления, которое удерживает жидкость внутри кровеносных сосудов. Глобулины выполняют иммунную функцию (антитела), обеспечивают нормальное свертывание крови (фибриноген), а также представлены ферментами, гормонами и белками-переносчиками разнообразных биохимических соединений.
Отклонение уровня общего белка крови от нормы может быть вызвано рядом физиологических состояний (не патологического характера) или являться симптомом различных заболеваний. Принято различать относительное отклонение (связанное с изменением содержания воды в циркулирующей крови) и абсолютное (вызванное изменениями в обмене – скорости синтеза/распада – сывороточных белков).
Физиологическая абсолютная гипопротеинемия может возникать при длительном постельном режиме, у женщин во время беременности (особенно в ее последней трети) и кормления грудью, у детей в раннем возрасте, то есть в условиях недостаточного поступления белка с пищей или повышенной потребности в нем. В этих случаях показатель общего белка в крови снижается.
Развитие физиологической относительной гипопротеинемии (понижения уровня общего белка в крови) связано с избыточным поступлением жидкости (повышенной водной нагрузкой).
Относительная гиперпротеинемия (повышение уровня общего белка в крови) может быть вызвана избыточной потерей воды, как, например, при обильном потоотделении.
Относительная патологическая (связанная с каким-либо заболеванием) гиперпротеинемия обусловлена значительной потерей жидкости и сгущением крови (при обильной рвоте, поносе или хроническом нефрите).
Патологическая относительная гипопротеинемия наблюдается в обратных случаях – при избыточной задержке жидкости в циркулирующей крови (нарушение работы почек, ухудшение работы сердца, некоторые гормональные нарушения и т. д.).
Абсолютное повышение общего белка крови может возникать при острых и хронических инфекционных заболеваниях из-за усиленной продукции иммунных глобулинов, при некоторых редких расстройствах здоровья, характеризующихся интенсивным синтезом ненормальных белков (парапротеинов), при заболеваниях печени и др.
Наибольшее клиническое значение имеет абсолютная гипопротеинемия. Абсолютное снижение концентрации общего белка в крови чаще всего происходит за счет уменьшения количества альбуминов. Нормальный уровень альбуминов в крови является показателем хорошего здоровья и правильного обмена веществ, и наоборот, пониженный говорит о низкой жизнеспособности организма. При этом потеря / разрушение / недостаточный синтез альбуминов является признаком и показателем степени тяжести некоторых заболеваний. Таким образом, анализ на общий белок крови позволяет выявить существенное снижение жизнеспособности организма в связи с какими-либо важными для здоровья причинами или сделать первый шаг в диагностике заболевания, связанного с нарушением белкового обмена.
Истощение запасов альбумина в крови может происходить при недоедании, заболеваниях желудочно-кишечного тракта и трудностях в усвоении пищи, хронических интоксикациях.
К заболеваниям, связанным с уменьшением количества альбуминов крови, относятся некоторые нарушения в работе печени (снижение синтеза белка в ней), почек (потеря альбуминов с мочой в результате нарушения механизма фильтрации крови в почках), определенные эндокринные расстройства (нарушения гормональной регуляции белкового обмена).
Референсные значения (норма общего белка в крови)
0 — 7 мес.——-44 – 76 г/л
7 — 12 мес.——51 — 73 г/л
1 — 3 год———56 — 75 г/л
3 — 18 лет———60 — 80 г/л
> 18 лет———-64 — 83 г/л
Результаты анализа на общий белок в сыворотке крови позволяют оценить состояние здоровья, рациональность питания и функцию внутренних органов по эффективности их работы в отношении поддержания нормального белкового обмена. Если выявлено отклонение от нормы, для уточнения его причины требуется дальнейшее обследование.
Причины повышения уровня общего белка в крови
Острая и хроническая инфекция (включая туберкулез),
нарушение функции коры надпочечников,
аутоиммунные заболевания (ревматоидный артрит, системная красная волчанка, склеродермия),
аллергические состояния,
некоторые редкие системные заболевания,
потеря жидкости (диабетический ацидоз, хронический понос и др.),
дыхательная недостаточность,
разрушение эритроцитов,
активный хронический гепатит,
некоторые редкие заболевания крови.
Причины понижения уровня общего белка в крови
Задержка жидкости в связи с нарушением функции почек или ослаблением работы сердца,
недостаточность поступления белка в организм или нарушение усвоения пищи в желудочно-кишечном тракте (вследствие голодания, недоедания, сужения пищевода, заболеваний кишечника воспалительного характера),
снижение синтеза белка в печени (из-за гепатита, цирроза/атрофии печени, интоксикации),
врождённые нарушения синтеза отдельных белков крови,
повышенный распад белка (как результат злокачественных новообразований, гиперфункции щитовидной железы, послеоперационного состояния, длительной лихорадки, травмы, долгого лечения гормональными противовоспалительными препаратами),
чрезмерная потеря белка при заболеваниях почек, сахарном диабете, кровотечениях,
потеря белка вместе с жидкостью, которая накапливается в брюшной полости и полости плевры.
Что может влиять на результат?
Прием пищи может существенно повысить содержание белка в крови, в то время как после физической нагрузки оно снижается. На концентрацию белка также способны влиять употребление чая, кофе, алкоголя, лекарственных средств. Кроме того, для наиболее точного результата пациенту следует воздержаться от пищи со значительным количеством жиров.
14. Альбумин (ALBUMIN) — важнейший белок крови, составляющий примерно половину всех сывороточных белков. Любое изменение его концентрации довольно быстро отражается на состоянии организма. Наибольшее клиническое значение имеет снижение количества альбумина в крови, которое встречается достаточно часто и может быть проявлением острых и хронических заболеваний печени (гепатит, цирроз, рак печени, тяжелое токсическое ее поражение, вторичные изменения печеночных клеток с нарушением их белковосинтетической функции при сердечной недостаточности, заболеваниях крови и др.).
Уменьшение содержания альбумина может быть также проявлением некоторых болезней почек, сопровождающихся значительной потерей альбумина с мочой (гломерулонефрит, амилоидоз, рак почек, поражение почек при сахарном диабете), других заболеваний, протекающих с нефротическим синдромом. В некоторых случаях причиной снижения уровня альбумина в крови являются острые и хронические болезни кишечника, опухоли его. Независимо от причины, снижение концентрации альбумина в крови влечет за собой появление отеков у больного.
Повышение альбумина в плазме встречается редко и чаще всего связано с обезвоживанием организма («ложная» гиперальбуминемия), либо с избыточным внутривенным введением препарата альбумина при лечении в стационаре.
Альбумин — самый обильный белок в человеческой плазме, составляющий около 60% всех белков плазмы. Альбумин также присутствует во внеклеточном пространстве, где его общее количество превышает содержание во внутрисосудистом пространстве на 30%. Альбумин синтезируется в печени из аминокислот. Выработка альбумина стимулируется тироксином и анаболическими стероидами.
Функции альбумина:
— поддержание рН крови, вязкости и онкотического давления плазмы на физиологическом уровне.
— транспорт нерастворимых в воде молекул, билирубина, лекарственных препаратов.
— участие в метаболизме кальция.
— поддержние объёма циркулирующей крови.
При уменьшении содержания альбумина в крови онкотическое давление плазмы снижается, жидкость усиленно покидает сосудистое русло, в связис чем происходит сгущение крови, замедление кровотока, а в межклеточном пространстве образуется избыток жидкости и развивается отёк.
Как подготовиться:
Специальной подготовки к исследованию не требуется. Необходимо следовать общим требованиям подготовки к исследованиям.
15. Глобулин ГСПГ (GLOBULIN) (Глобулин связывающий половые гормоны) Это белок плазмы крови, участвующий в связывании и транспорте половых гормонов, вырабатывается в печени. При снижении концентрации этого глобулина доля свободно циркулирующих в крови гормонов увеличивается. В этом случае эффекты гормонов усиливаются, хотя общая концентрация гормона может не выходить за пределы референсных значений.
У женщин в третьем триместре беременности содержание ГСПГ значительно увеличивается. Андрогены тормозят синтез ГСПГ. После 60 лет содержание ГСПГ растет примерно на 1,2% в год. Соответственно увеличивается количество связанного с ним тестостерона. Таким образом, с возрастом уровень биологически активного тестостерона снижается в большей степени, чем уровень общего тестостерона. Установлено, что у 50 % мужчин в возрасте 50 — 70 лет уровень биодоступного тестостерона ниже нормального уровня гормона для мужчин в возрасте 20 — 40 лет. Но высокая сывороточная концентрация этого глобулина является маркером благоприятного состояния сердечно — сосудистой системы.
16. Мочевая кислота (ACID URIC)
Мочевая кислота – это продукт катаболизма пуриновых оснований, входящих в состав ДНК и РНК всех клеток организма. Пурины появляются в основном после естественной гибели клеток, а меньшая их часть поступает с пищей (с печенью, красным мясом, бобовыми, рыбой) и жидкостями (с пивом, вином). Мочевая кислота транспортируется кровью от печени (там с ней взаимодействует фермент ксантиноксидаза) до почек, где около 70 % ее фильтруется и выделяется с мочой, оставшаяся часть попадает в желудочно-кишечный тракт и удаляется со стулом.
Если мочевой кислоты производится слишком много или недостаточно выделяется с мочой, она накапливается в организме, что проявляется ее высокой концентрацией в крови (гиперурикемией). Постоянно повышенный уровень мочевой кислоты может быть причиной подагры – воспаления суставов, при котором кристаллы мочевой кислоты откладываются в суставной (синовиальной) жидкости. Кроме того, отложение уратов и формирование камней в мочевыделительной системе – тоже следствие высокого уровня мочевой кислоты в крови.
Повышение уровня мочевой кислоты бывает вызвано возросшей гибелью клеток (из-за противоопухолевой терапии) или реже врождённой склонностью к повышенному производству мочевой кислоты. К недостаточному выведению мочевой кислоты обычно приводит снижение функции почек при их поражении. Во многих случаях точная причина избыточного накопления мочевой кислоты остается неизвестной.
Ускоренные процессы гибели клеток, а также снижение скорости выделения мочевой кислоты почками вызывает гиперурикемию – повышение концентрации мочевой кислоты в крови. В результате она откладывается в суставах и мягких тканях, воспаление переходит на внутрисуставные кристаллы уратов. К тому же образуются камни в мочевыделительной системе.
Референсные значения
Мужчины — 202,3 — 416,5 мкмоль/л
Женщины — 142,8 — 339,2 мкмоль/л
Причины повышенного уровня мочевой кислоты
1) частая гибель большого количества клеток и их не менее интенсивное обновление (в таком случае происходит активный обмен генетической информации, а значит, и нуклеиновых кислот, продуктами деградации которых являются азотистые основания, а затем и мочевая кислота, образующаяся в большом количестве),
2) снижение скорости фильтрации и выделения мочевой кислоты почками.
Исходя из этого, основные причины повышения уровня мочевой кислоты:
злокачественные новообразования с метастазами, множественная миелома, лейкоз – почти все онкологические заболевания характеризуются бесконтрольным ростом и делением клеток,
лучевая и химиотерапия неопластических процессов в организме,
хроническая почечная недостаточность.
острая сердечная недостаточность,
гемолитическая и серповидно-клеточная анемия,
гипопаратиреоз,
гипотиреоз,
диабетический кетоацидоз,
гиперлипидемия, ожирение,
обострение псориаза,
отравление свинцом,
синдром Дауна,
синдром Леша-Нихена
Причины пониженного уровня мочевой кислоты:
заболевания печени (нарушения процесса метаболизма мочевой кислоты из-за недостатка или снижения активности ферментов),
синдром Фанкони (снижение канальцевой реабсорбции мочевой кислоты из-за дефекта развития канальцев почек),
токсикоз,
алкоголизм,
болезнь Вильсона-Коновалова,
ксантинурия (мочевой кислоты образуется мало из-за недостаточности фермента ксантиноксидазы),
синдром патологической секреции антидиуретического гормона.
Важные замечания
Людям, больным подагрой и/или мочекаменной болезнью, лучше избегать продуктов с высоким содержанием пурина (это мясо, рыба, грибы и др.). Стоит существенно ограничить и прием алкоголя, потому что он замедляет выведение мочевой кислоты из организма.
Результаты теста на мочевую кислоту в крови не могут служить стопроцентным основанием для постановки диагноза «подагра».
В норме одна треть всей мочевой кислоты подвергается переработке бактериями биоценоза кишечника.
Во время беременности увеличение содержания мочевой кислоты является тревожным знаком возможного развития в ближайшее время преэклампсии и эклампсии.
Высокий уровень мочевой кислоты в крови не всегда ведет к выраженным симптомам, у 10 % взрослых гиперурикемия протекает бессимптомно. Людям с наследственной предрасположенностью к подагре, образованию камней или поражению почек следует проводить профилактику этих заболеваний, несмотря на отсутствие симптомов.
Некоторые исследования показывают, что чрезмерное количество мочевой кислоты повышает риск заболеваний сердца. Считается, что это играет роль в течении сахарного диабета, в ухудшении липидного обмена, повышении артериального давления и увеличивает вероятность инсульта и эклампсии. Но непосредственными следствиями гиперурикемии являются 2 состояния: подагра и мочекаменная болезнь.
17. Аланинаминотрансфераза (АЛТ)(AlT) – это фермент, который присутствует главным образом в клетках печени и почек и в заметно меньших количествах в клетках сердца и мышц. У здоровых людей активность в крови невелика, норма АЛТ имеет низкие значения. При поражении клеток ткани печени АЛТ высвобождается в кровоток обычно еще до появления таких характерных симптомов, как желтуха. В связи с этим активность данного фермента используется в качестве показателя повреждений печени. Вместе с другими исследованиями, выполняющими те же задачи, анализ на АЛТ входит в состав так называемых печеночных проб.
Печень является жизненно важным органом, который расположен в верхней правой части брюшной полости. Она участвует в осуществлении многих важных функций организма – в переработке питательных веществ, производстве желчи, синтезе белков, таких как факторы свертывающей системы крови, а также расщепляет потенциально токсичные соединения до безопасных веществ.
Ряд заболеваний приводит к повреждению клеток печени, что способствует повышению активности АЛТ.
Наибоее часто анализ на АЛТ назначают, чтобы проверить, не повреждена ли печень при гепатите и приеме лекарственных препаратов либо иных веществ, которые являются токсичными для данного органа. Однако АЛТ не всегда отражает только повреждения печени, активность этого фермента может повышаться и при заболеваниях других органов.
АСТ и АЛТ считаются двумя наиболее важными показателями повреждений печени, хотя АЛТ более специфичен, чем АСТ. В некоторых случаях АСТ напрямую сопоставляется с АЛТ и вычисляется их соотношение (АСТ/АЛТ). Оно может использоваться для выявления причин повреждения печени.
Референсные значения (норма АЛТ для мужчин, женщин и детей)
0 — 1 год——< 56 Ед/л
1 — 4 года—-< 29 Ед/л
4 — 7 лет——< 29 Ед/л
7 — 13 лет——< 37 Ед/л
13 — 18 лет—-< 37 Ед/л
> 18 лет-мужчины< 41 Ед/л
> 18 лет — женщины< 33 Ед/л
В норме активность АЛТ в крови очень низкая.
Причины повышенной активности АЛТ:
вирусные инфекции (чрезмерно высокая активность АЛТ – более чем в 10 раз больше нормы – наблюдается, например, при острых гепатитах; при хроническом гепатите оно обычно превышает норму не более чем в 4 раза);
прием лекарств или иных веществ, которые являются токсичными для печени;
болезни, замедляющие приток крови к печени (ишемии);
непроходимость желчных путей, цирроз (обычно в результате хронического гепатита или закупорки желчных путей) и опухоль печени (умеренное повышение АЛТ).
При большинстве заболеваний печени активность АЛТ выше активности АСТ, так что соотношение АСТ/АЛТ будет низким. Однако существует несколько исключений: алкогольный гепатит, цирроз и повреждение мышц.
Важные замечания
Внутримышечные инъекции, а также интенсивная физическая нагрузка могут повышать активность АЛТ в организме.
У некоторых пациентов повреждение печени и, как следствие, увеличение активности АЛТ может быть вызвано приемом БАД. Поэтому необходимо информировать лечащего врача не только обо всех принимаемых лекарствах, но и о пищевых добавках. Кроме того, частое употребление фастфуда способно приводить к незначительному повышению активности АЛТ посредством повреждения печени; в случае нормализации питания активность АЛТ возвращается к норме.
18. Аспартатаминотрансфераза (АСТ)(AST) — это фермент, который находится во всех клетках организма, однако главным образом в сердце и печени и в меньшей степени в почках и мышцах. У здоровых пациентов активность АСТ в крови невелика и норма АСТ имеет низкие значения. При повреждении печени или мышц АСТ высвобождается, содержание АСТ в крови повышается. В связи с этим активность данного фермента является показателем повреждений печени. Анализ на АСТ входит в состав так называемых печеночных проб — исследований, диагностирующих нарушения в работе печени.
Печень является жизненно важным органом, который расположен в верхней правой части брюшной полости. Она участвует в осуществлении многих важных функций организма – помогает в переработке питательных веществ, производстве желчи, синтезе многих важных белков, таких как факторы свертывающей системы крови, а также расщепляет потенциально токсичные соединения до безопасных веществ.
Ряд заболеваний приводит к повреждению клеток печени, что способствует повышению активности АСТ.
Наиболее часто анализ на АСТ назначают, чтобы проверить, не повреждена ли печень из-за гепатита, приема токсичных препаратов, цирроза. Однако АСТ не всегда отражает только повреждения печени, активность этого фермента может повышаться и при заболеваниях других органов, в частности при инфаркте миокарда.
Референсные значения (норма АСТ для мужчин, женщин и детей)
0 — 1 год——< 58 Ед/л
1 — 4 года—-< 59 Ед/л
4 — 7 лет——< 48 Ед/л
7 — 13 лет——< 44 Ед/л
13 — 18 лет—-< 39 Ед/л
> 18 лет- мужчины < 40 Ед/л
> 18 лет — женщины < 32 Ед/л
В норме активность АСТ в крови низкая.
Чрезмерно высокая активность АСТ (более чем в 10 раз больше нормы) обычно вызвана вирусными инфекциями. Также она может значительно увеличиваться в результате приема лекарств или иных веществ, которые являются токсичными для печени, а также из-за болезней, замедляющих приток крови к печени (ишемии).
При хроническом гепатите активность АСТ обычно превышает норму не более чем в 4 раза. Она колеблется между нормальной и несколько повышенной, поэтому часто для выяснения степени заболевания и назначается анализ. Такие заболевания, как непроходимость желчных путей, цирроз и некоторые виды рака печени способствуют умеренному повышению АСТ. После перенесенного инфаркта и при повреждении мышц активность АСТ также может повышаться, обычно намного больше АЛТ.
При большинстве заболеваний печени активность АЛТ в крови выше активности АСТ, так что соотношение АСТ/АЛТ будет низким. Однако существует несколько исключений: алкогольный гепатит, цирроз и повреждение мышц.
Важные замечания
При беременности активность АСТ может понижаться.
Внутримышечные инъекции лекарственных препаратов, а также интенсивная физическая нагрузка способствуют повышению активности АСТ в крови.
У некоторых пациентов повреждение печени и, как следствие, увеличение активности АСТ может быть вызвано приемом БАД. Поэтому необходимо информировать лечащего врача не только обо всех принимаемых лекарствах, но и о пищевых добавках.
19.ГТП (гамма-глутамилтранспептидаза)(y-GTP)
Это фермент, участвующий в обмене аминокислот. Основное содержание гамма-глютамилтрансферазы — в печени, почках и поджелудочной железе. В крови здорового человека содержание гаммы-глютамилтрансферазы незначительно. У новорожденных в 2-4 раза выше, чем у взрослых.
Когда значение гамма-глютамилтрансферазы повышено?
Желчекаменная болезнь.
Состояния, сопровождающиеся внутри- , внепеченочным холестазом (механическая желтуха).
Острый вирусный и хронический гепатит.
Диагностика радиационного поражения печени.
Острые и хронические панкреатиты.
Гипертиреоз.
Алкоголизм.
Заболевания почек (гломеруло- , пиелонефрит).
Рак поджелудочной, предстательной железы, печени.
Прием некоторых гепатотоксичных препаратов (барбитураты, фенатоин, цефалоспорины и др.).
20. Амилаза (AMYLASE) – пищеварительный фермент, который способен расщеплять углеводы.
Наибольшее количество амилазы содержится в слюнных и поджелудочной железах.
Амилаза, которая вырабатывается в поджелудочной железе, – панкреатическая амилаза (P-тип) – входит в состав панкреатического сока. Из поджелудочной железы панкреатический сок, содержащий липазу, через панкреатический проток попадает в двенадцатиперстную кишку, где помогает переварить пищу.
Амилаза слюнных желез – слюнная амилаза (S-тип) – осуществляет переваривание крахмала пищи в ротовой полости.
В норме в крови циркулирует небольшое количество амилазы. При этом около 60 % составляет слюнная амилаза (S-тип), а остальные 40 % – панкреатическая амилаза.
Когда происходит повреждение поджелудочной железы, как при панкреатите, или если панкреатический проток блокируется камнем или опухолью, панкреатическая амилаза (P-тип) начинает в больших количествах попадать в кровоток. Повышения активности слюнной амилазы при этом не происходит.
Небольшие количества амилазы образуются также в яичниках, кишечнике и скелетной мускулатуре.
Референсные значения
< 1 года ——< 8 Ед/л
1 — 10 лет—-< 31 Ед/л
10 — 18 лет—< 39 Ед/л
> 18 лет——< 53 Ед/л
Интерпретация результатов анализа на панкреатическую амилазу производится с учетом оценки общей активности амилазы в крови или моче. Если общая активность амилазы повышена, а активность панкреатической амилазы снижена, то поражение поджелудочной железы маловероятно и требуется исключение патологии яичников, кишечника, бронхов или других органов.
Причины повышения активности панкреатической амилазы
Острый панкреатит. При этом заболевании активность панкреатической амилазы может быть значительно выше нормы и составлять больший процент от активности общей амилазы. Тем не менее у некоторых больных острым панкреатитом амилаза может повышаться незначительно или даже оставаться в норме. Вообще, активность амилазы не отражает тяжести поражения поджелудочной железы при панкреатите. К примеру, при массивном панкреатите иногда происходит гибель большинства клеток, вырабатывающих этот фермент, поэтому его активность может быть не изменена.
Хронический панкреатит. При нем активность амилазы сначала умеренно повышена, однако затем может снижаться и приходить в норму по мере усугубления поражения поджелудочной железы.
Декомпенсация сахарного диабета – диабетический кетоацидоз как из-за высокого уровня сахара, так и из-за сопутствующего вовлечения в патологический процесс поджелудочной железы.
Травма поджелудочной железы.
Рак поджелудочной железы.
Закупорка (камнем, рубцом) панкреатического протока.
Острый аппендицит, перитонит.
Перфорация (прободение) язвы желудка.
Острый холецистит – воспаление желчного пузыря.
Кишечная непроходимость.
Разрыв аневризмы аорты.
Макроамилаземия – состояние, когда амилаза соединяется с крупными белками в сыворотке и поэтому не может пройти через почечные клубочки, накапливаясь в крови.
Причины понижения активности панкреатической амилазы
Снижение функции поджелудочной железы.
Муковисцидоз (кистозный фиброз) поджелудочной железы – тяжелое наследственное заболевание, связанное с поражением желез внешней секреции (легких, желудочно-кишечного тракта).
Удаление поджелудочной железы.
21. Липаза (LIPASE) — фермент, играющий главную роль в расщеплении жиров. Он вырабатывается рядом органов и тканей, поэтому различают липазу поджелудочной железы (панкреатическая липаза), липазу кишечного сока, желудочную, липазу лейкоцитов и др. В практике наибольшее значение имеет липаза, вырабатываемая клетками поджелудочной железы, так как именно ее активность является важнейшим фактором в процессе переваривания жиров.
Чаще всего повышение активности липазы наблюдается при патологии поджелудочной железы, что связано с повреждением ее клеток и выходом фермента в кровь. Наиболее значимое повышение данного показателя отмечается при остром панкреатите, причем активность липазы нередко возрастает раньше, чем активность амилазы, достигая максимума к концу первых суток заболевания, и сохраняется более длительное время (до 10-12 дней). Кроме того, повышение активности липазы часто отмечается при обострении хронического панкреатита, раке поджелудочной железы, ее кистах. Более редкими причинами увеличения данного показателя могут быть желчнокаменная болезнь, кишечная непроходимость, некоторые виды перитонита, переломы крупных трубчатых костей.
В тонком кишечнике липаза отвечает за расщепление нейтральных жиров — триглицеридов — сложных эфиров — глицерола и высших карбоновых кислот. Уровни липазы в сыворотке не имеют достоверных различий у мужчин и женщин. При воспалении поджелудочной железы этот фермент попадает в кровяное русло. После острого панкреатита активность липазы в сыворотке возрастает через 4 — 8 часов, достигая пика через 24 часа, и снижается через 8 — 14 дней.
Определение липазы при панкреатитах имеет более высокую клиническую чувствительность и специфичность, чем исследование амилазы.
22. Щелочная фосфатаза(ALK PHOS) — Щелочная фосфатаза – фермент, который находится в клетках печени и желчевыводящих путей и является катализатором определенных биохимических реакций в этих клетках (в кровеносном русле он не работает). При разрушении этих клеток их содержимое попадает в кровь. В норме часть клеток обновляется, поэтому в крови обнаруживается определенная активность щелочной фосфатазы. Если гибнет много клеток, она может повышаться очень значительно.
Желчь образуется в клетках печени и выделяется по системе внутрипеченочных желчевыводящих канальцев. Они затем объединяются в печеночные протоки, которые выходят за пределы печени и образуют общий желчный проток, впадающий в тонкий кишечник.
Желчь необходима для всасывания жиров, поступающих с пищей. Также посредством желчи выделяются некоторые лекарственные вещества. Она образуется постоянно, но поступает в кишечник только во время и после приема пищи. Когда она не нужна, она накапливается в желчном пузыре.
Активность щелочной фосфатазы сильно увеличивается при препятствиях оттоку желчи, например камнях в желчных протоках. Такой застой желчи называется холестазом.
В костях щелочная фосфатаза образуется в специальных клетках – остеобластах, которые играют важную роль в формировании и обновлении костной ткани. Чем выше активность остеобластов, тем выше активность щелочной фосфатазы в крови, поэтому у детей и лиц, перенесших переломы костей, активность щелочной фосфатазы на высоком уровне.
Щелочная фосфатаза также содержится в клетках кишечника и плаценты.
Что означают результаты?
Возраст, пол Референсные значения
< 15 дней 83 — 248 Ед/л
15 дней – 1 год 122 – 469 Ед/л
1-10 лет 142 — 335 Ед/л
10-13 лет 129 — 417 Ед/л
13-15 лет женский 57 — 254 Ед/л
13-15 лет мужской 116 — 468 Ед/л
15-17 лет женский 50 — 117 Ед/л
15-17 лет мужской 82 — 331 Ед/л
17-19 лет женский 45 — 87 Ед/л
17-19 лет мужской 55 — 149 Ед/л
> 19 лет женский 35 — 105 Ед/л
> 19 лет мужской 40 — 130 Ед/л
Причины повышения активности щелочной фосфатазы
1. Поражение печени и желчевыводящих путей.
Механическая желтуха, связанная с непроходимостью желчевыводящих протоков.
Камни желчных протоков, рубцы желчных протоков после хирургических вмешательств.
Опухоли желчных протоков.
Рак головки поджелудочной железы, рак желудка при механическом сдавливании общего желчного протока, через который желчь попадает в 12-перстную кишку.
Рак печени, метастазы опухолей других органов в печень.
Цирроз печени – патологический процесс, в ходе которого происходит замещение нормальной печеночной ткани рубцовой, что угнетает все функции печени.
Гепатит любого происхождения (обычно ЩФ из-за него становится в 3 раза больше нормы).
Инфекционный мононуклеоз – острая вирусная инфекция, проявляющаяся повышением температуры, воспалением зева и увеличением лимфоузлов. При этом в патологический процесс часто вовлекается печень.
Первичный билиарный цирроз и первичный склерозирующий холангит – это редкие заболевания, которые встречаются у взрослых людей и связаны с аутоиммунным повреждением желчных ходов. Сопровождаются крайне высокой активностью щелочной фосфатазы и гамма-глутамилтрансферазы
2. Поражение костей.
Особенно высокая активность ЩФ (15-20 норм) отмечается при болезни Педжета. Это заболевание, которое сопровождается патологическим ростом костей и нарушением их структуры в определенных местах.
Остеосаркома.
Метастазы других опухолей в кости.
Остеомаляция – размягчение костей, вызванное недостатком кальция. 3. Другие причины.
Гиперпаратиреоз – гормональное заболевание, связанное с избыточным образованием паратгормона околощитовидными железами, что приводит к вымыванию кальция из костей.
Инфаркт миокарда.
Язвенный колит, перфорация кишечника (так как щелочная фосфатаза содержится в том числе и в клетках кишечника).
Причины понижения активности щелочной фосфатазы
Тяжелая анемия.
Массивные переливания крови.
Гипотиреоз – состояние, при котором снижена функция щитовидной железы.
Недостаток магния и цинка.
Гипофосфатазия – редкое врождённое заболевание, приводящее к размягчению костей.
Выраженное снижение щелочной фосфатазы у беременных – признак недостаточности плаценты.
Что может влиять на результат?
При беременности в норме активность щелочной фосфатазы повышена, так как она содержится в плаценте.
Временное повышение активности ЩФ отмечается после переломов.
У детей и юношей активность ЩФ выше, чем у взрослых, так у них происходит рост костей.
Аспирин, парацетамол, аллопуринол, антибиотики и ряд других лекарств способны повышать активность щелочной фосфатазы.
Прием оральных контрацептивов иногда приводит к снижению активности щелочной фосфатазы.
Активность щелочной фосфатазы может быть завышенной, если кровь после взятия охлаждалась.
23. Лактатдегидрогеназа (LDH) — фермент, участвующий в белковом обмене клеток, содержится в наибольшем количестве в клетках печени, сердца, почек, скелетных мышцах, эритроцитах. Определение ЛДГ используется при диагностике инфаркта миокарда, гемолитической анемии (повреждение эритроцитов), опухолевых процессах.
ЛДГ состоит из пяти различных изоферментов, катализирующих превращение L-лактата в пируват и наоборот, ЛДГ присутствует в цитоплазме всех тканей человека, в высоких концентрациях в печени, сердечной и скелетных мышцах, в меньших концентрациях в эритроцитах, поджелудочной железе, почках и желудке. Увеличение активности ЛДГ обнаруживается при различных патологических состояниях, таких как инфаркт миокарда, рак, болезни печени, крови или мышц. Однако, для дифференциальной диагностики, из-за отсутствия органоспецифичности ЛДГ, необходимо определение ее изоферментов, либо других ферментов, таких как щелочная фосфатаза или АЛТ/АСТ.
Повышение общей активности ЛДГ
1). Инфаркт миокарда (через 10-12 часов после инфаркта до 8 суток).
2). Пернициозная анемия.
3). Гемолитические анемии при дефиците витамина В 12 и фолиевой кислоты.
4). Воспалительные заболевания печени.
5). Вирусные гепатиты (особенно в острой фазе).
6). Алкогольная интоксикация.
7). Воспаление легких.
8). Инфаркт легких.
9). Злокачественные новообразования (особенно в печени).
10). Лейкозы.
11). Эритремии.
12). Заболевания мышц и повреждения скелетной мускулатуры — травмы, мышечная дистрофия, дерматомиозит.
13). Реже при болезнях почек и остром панкреатите.
24. Фосфор (PHOSPHORUS) – это минерал, находящийся в организме в виде органических и неорганических соединений. Термины «фосфор» и «фосфаты» взаимозаменяемы, когда говорится о проверке уровня вещества в организме, однако стоит учитывать, что подсчитывается количество неорганического фосфата.
Фосфор необходим организму для производства энергии, выполнения функций мышечной и нервной системы, а также для роста костей. Фосфаты, являясь своеобразным буфером, играют важную роль в поддержании кислотно-щелочного баланса.
Фосфор попадает в организм с пищей. Находясь в составе многих продуктов питания, он достаточно быстро всасывается в тонком кишечнике. Около 70-80 % фосфора в организме связано с кальцием, формируя каркас костей и зубов, 10 % находится в мышцах и около 1 % в нервной ткани. Оставшаяся часть содержится во всех клетках организма в качестве запаса энергии. В норме около 1 % всего фосфора находится в крови. Многие продукты питания (фасоль, горошек, орехи, злаки, растительные масла, яйца, говядина, курица, рыба) содержат значительное количество фосфатов. Стабильная концентрация фосфора поддерживается регуляцией процессов всасывания в кишечнике и выделения в почках. К тому же уровень фосфатов зависит от количества паратиреоидного гормона, кальция и витамина D.
К недостатку фосфора (гипофосфатемии) приводят расстройства кислотно-щелочного баланса, неполноценность питания, мальабсорбция, гиперкальциемия и нарушения, влияющие на процессы выделения в почках. Причиной избытка фосфора (гиперфосфатемии) может быть чрезмерное поступление минерала с пищей, гипокальциемия и поражение почек.
У людей с умеренным дефицитом этого минерала симптомы его недостаточности могут не проявляться. О сильной нехватке фосфора говорит мышечная слабость и спутанность сознания. Интересно, что признаки избытка фосфора похожи на симптомы недостаточности кальция: мышечные судороги, оцепенение, потеря сознания.
Фосфорный и кальциевый обмены тесно взаимосвязаны: при понижении концентрации кальция уровень фосфора повышается, повышенная концентрация одного электролита в плазме ведет к усиленному выделению почками с мочой другого. Многие факторы, увеличивающие содержание кальция, снижают уровень фосфора.
Что означают результаты?
Возраст Референсные значения
< 2 лет 1,45 — 2,16 ммоль/л
2 — 12 лет 1,45 — 1,78 ммоль/л
> 12 лет 0,81 — 1,45 ммоль/л
Низкий уровень фосфора может быть вызван:
передозировкой диуретиков (бесконтрольной потерей фосфатов с мочой),
недостаточным поступлением фосфора с пищей,
алкоголизмом (чаще всего при этом есть еще ферментная недостаточность, нарушения питания и всасывания),
ожоговой болезнью (соответственно, нарушением баланса многих видов обмена и излишней потерей электролитов и жидкости с пораженной поверхности),
диабетическим кетоацидозом (из-за усиления метаболизма углеводов),
гипер- или гипотиреозом,
гипокалиемией,
постоянным применением антацидов,
рахитом (у детей) и остеомаляцией (у взрослых),
гиперинсулинизмом (инсулин участвует в транспорте глюкозы в клетки, невозможном без фосфатов),
заболеваниями печени,
септицемией,
сильной рвотой и/или диареей.
Высокий уровень фосфора (гиперфосфатемия) чаще всего связан с нарушением функции почек и уремией. Его причинами могут быть:
почечная недостаточность, любой тяжелый нефрит (с повышением уровня креатинина и мочевины),
гипопаратиреоз,
остеосаркомы, метастатическое поражение костей и миеломная болезнь,
диабетический кетоацидоз,
передозировка фосфоросодержащими препаратами,
переломы в стадии заживления,
передозировка витамина D,
болезнь Аддисона (недостаточная выработка гормонов надпочечниками),
акромегалия.
Что может влиять на результат?
Прием пищи перед сдачей крови может приводить к ложному понижению уровня фосфора.
Уровень фосфора в крови, взятой вечером, будет выше результата от утреннего образца (из-за суточных колебаний концентрации минерала).
Гемодиализ способствует понижению концентрации фосфора.
Лекарственные препараты, повышающие уровень фосфора: анаболические стероиды, андрогены, бета-адренергические блокаторы, этанол, эргокальциферол, фуросемид, гормон роста, гипотиазид, фосфоросодержащие препараты, витамин D, тетрациклин, метициллин, инъекционные контрацептивы.
Лекарственные препараты, понижающие уровень фосфора: диакарб, антациды, содержащие алюминий, аминокислоты, анестетики, кальцитонин, карбамазепин, адреналин, эстрогены, глюкокортикоиды, инсулин, изониазид, пероральные контрацептивы, фенитоин, сукральфат, маннитол.
Важные замечания
Постоянно высокий уровень фосфора опасен повреждением органов из-за кальцификации (отложения фосфата кальция в тканях).
В норме концентрация фосфора выше у детей, чем у взрослых. Это связано с повышенной секрецией гормона роста вплоть до пубертатного периода.
После приема слабительных, содержащих фосфат натрия, уровень фосфора через 2-3 часа возрастает. Хотя подъем временный (на 5-6 часов), этот фактор должен учитываться при невозможности объяснить причину повышения концентрации фосфора ничем другим.
Избыточное введение витамина D, а также внутривенное введение глюкозы могут повлиять на уровень фосфора в крови и в моче (фосфаты способствуют перемещению глюкозы в клетки).
Чаще всего изменения уровня фосфора выявляются при поиске причин изменения концентрации кальция.
При интерпретации причин отклонения от нормы концентрации фосфора стоит брать во внимание и уровень кальция.
25. Железо в сыворотке (SERUM IRON) – это микроэлемент, который всасывается из пищи и затем переносится по организму трансферрином – специальным белком, образующимся в печени. Железо необходимо для образования эритроцитов. Оно является важнейшей составной частью гемоглобина – белка, заполняющего эритроциты, который позволяет им переносить кислород от легких к органам и тканям. Железо также входит в состав мышечного белка миоглобина и некоторых ферментов.
В норме в организме содержится 4-5 г железа. Около 70 % от этого количества составляет железо, «встроенное» в гемоглобин эритроцитов, оставшееся в основном запасается в тканях в виде ферритина и гемосидерина. Когда железа начинает не хватать, например в случае уменьшения приема его с пищей или частых кровотечений, и его уровень в крови уменьшается, организм использует железо из резерва. При длительной нехватке запасы железа истощаются, что может привести к анемии. С другой стороны, если железа поступает слишком много, то это может вызывать его чрезмерное накопление и поражение печени, сердца и поджелудочной железы.
На ранних стадиях дефицит железа может протекать бессимптомно. Если человек в остальном здоров, то признаки заболевания проявляются только при снижении гемоглобина ниже 100 г/л. Для анемии характерны хроническая слабость, головокружение, головные боли.
При тяжелой железодефицитной анемии человек может жаловаться на одышку, боль в грудной клетке, сильные головные боли, слабость в ногах. У детей возможны трудности с обучением. Помимо основных, есть еще несколько признаков, характерных для дефицита железа: желание употреблять в пищу необычные продукты (мел, глину), жжение кончика языка, заеды (трещины в углах рта).
Симптомы избытка железа: боль в суставах, слабость, усталость, боль в животе, снижение сексуального влечения, нарушения сердечного ритма.
Около 3-4 мг железа (0,1 % от общего количества) циркулирует в крови «в связке» с белком трансферрином. Именно его уровень измеряется при данном анализе.
Количество сывороточного железа может значительно варьироваться в разные дни и даже в течение одних суток (максимально в утренние часы). Поэтому измерение уровня сывороточного железа почти всегда сочетается с другими анализами, такими как тест на общую железосвязывающую способность сыворотки (ОЖСС), ферритин, трансферрин. Используя показатели ОЖСС и трансферрина, можно рассчитать процент насыщения трансферрина железом, который показывает, какое количество железа транспортируется кровью.
Применение разных анализов, отражающих обмен железа в организме, обеспечивает более полную и достоверную информацию о железодефиците или перенасыщении организма железом, чем изолированное измерение сывороточного железа.
Что означают результаты?
Возраст пол Референсные значения
< 1 мес. женский 5,2 — 22,7 мкмоль/л
< 1 мес. мужской 5,7 — 20 мкмоль/л
1 — 12 мес. женский 4,5 — 22,6 мкмоль/л
1 — 12 мес. мужской 4,8 — 19,5 мкмоль/л
1 — 4 года женский 4,5 — 18,1 мкмоль/л
1 — 4 года мужской 5,2 — 16,3 мкмоль/л
4 — 7 лет женский 5 — 16,7 мкмоль/л
4 — 7 лет мужской 4,5 — 20,6 мкмоль/л
7 — 10 лет женский 5,4 — 18,6 мкмоль/л
7 — 10 лет мужской 4,8 — 17,2 мкмоль/л
10 — 13 лет женский 5,7 — 18,6 мкмоль/л
10 — 13 лет мужской 5 — 20 мкмоль/л
13 — 16 лет женский 5,4 — 19,5 мкмоль/л
13 — 16 лет мужской 4,7 — 19,7 мкмоль/л
16 — 18 ле женский 5,9 — 18,3 мкмоль/л
16 — 18 ле мужской 4,8 — 24,7 мкмоль/л
> 18 лет женский 6,6 — 26 мкмоль/л
> 18 лет мужской 11 — 28 мкмоль/л
Интерпретация результатов обычно производится с учетом остальных показателей, оценивающих метаболизм железа.
Причины понижения уровня железа в сыворотке
Чаще всего железодефицитная анемия. Она обычно вызвана хронической кровопотерей или недостаточным употреблением мясных продуктов.
Хронические заболевания, такие как системная красная волчанка, ревматоидный артрит, туберкулез, бактериальный эндокардит, болезнь Крона и др.
Третий триместр беременности – снижение железа в этом случае является нормальным явлением из-за повышения потребности в нем.
Нарушение всасывания железа при различных заболеваниях кишечника, а также после удаления желудка.
Гемолитические анемии – связанные с разрушением эритроцитов.
Ранняя стадия лечения B12-дефицитной анемии.
Инфаркт миокарда.
Причины повышения уровня железа в сыворотке
Талассемия – наследственное заболевание, при котором изменена структура гемоглобина.
B12-дефицитная анемия.
Наследственный гемохроматоз. При этом заболевании из пищи всасывается повышенное количество железа, которое откладывается в различных органах, вызывая их повреждение.
Множественные переливания крови, введение железа внутримышечно, неадекватное назначение препаратов железа.
Острое отравление препаратами железа (у детей).
Острый гепатит.
Гломерулонефрит – воспаление ткани почек.
Что может влиять на результат?
Прием даже одной таблетки, содержащей железо, может на время значительно повысить концентрацию железа.
Алкоголь, эстрогены, оральные контрацептивы повышают уровень железа. Некоторые антибиотики, большие дозы аспирина, метформин (препарат для лечения сахарного диабета) и тестостерон снижают его.
Уровень железа повышается перед менструацией и снижается во время нее.
Некоторые биологически активные добавки (особенно содержащие железо или таниновую кислоту) могут влиять на уровень железа.
Прием витамина B12 за 48 часов до проведения анализа может приводить к повышению результата.
Хроническое недосыпание и сильный стресс снижают уровень железа.
Максимальный уровень железа отмечается в утренние часы, днем он ниже, вечером – минимален.
Dажные замечания
Организм в норме теряет железо за счет слущивания клеток кожи, а также с калом и потом. Для восполнения этих потерь ежедневно требуется, чтобы с пищей поступало не менее 1 мг железа, женщинам во время месячных – в два раза больше. Нормальное сбалансированное питание обеспечивает поступление 10-15 мг железа в день, всасывается около 10 % от этого количества. Основные источники железа в пище: мясо, рыба, зелень и крупы.
26. Кальций в сыворотке(CALCIUM)
Кальций – один из самых важных для человека минералов. Он необходим для сокращения скелетных мышц и сердца, для передачи нервного импульса, а также для нормальной свертываемости крови (способствует переходу протромбина в тромбин), для построения каркаса костей и зубов.
Около 99 % этого минерала сосредоточено в костях и лишь менее 1 % циркулирует в крови. Почти половина кальция в крови является метаболически активной (ионизированной), оставшаяся часть связана с белками (в основном с альбуминами) и с анионами (лактатом, фосфатом, бикарбонатом, цитратом) и является неактивной.
Общий кальций в крови – это концентрация свободной (ионизированной) и связанной его форм. Только свободный кальций может быть использован организмом.
Часть кальция ежедневно уходит из организма, фильтруясь из крови почками и выделяясь с мочой. Для поддержания равенства между выделением и использованием этого минерала его должно поступать около 1 г в сутки.
При повышении концентрации кальция в крови уровень фосфата снижается, когда же содержание фосфата повышается – снижается доля кальция.
Механизмы фосфорно-кальциевого обмена:
паращитовидные железы при высоком содержании фосфата (при низком уровне кальция) выделяют паратгормон, разрушающий костную ткань, тем самым увеличивая концентрацию кальция,
при высоком уровне кальция в крови щитовидная железа вырабатывает кальцитонин, который вызывает перемещение кальция из крови в кости,
гормон паращитовидных желез активирует витамин D, увеличивая всасывание кальция в ЖКТ и обратное всасывание катиона в почках.
Что означают результаты?
Возраст Референсные значения
Меньше 10 дней 1,9 — 2,6 ммоль/л
10 дней – 2 года 2,25 — 2,75 ммоль/л
2 — 12 лет 2,2 — 2,7 ммоль/л
12 — 18 лет 2,1 — 2,55 ммоль/л
18 — 60 лет 2,15 — 2,5 ммоль/л
60 — 90 лет 2,2 — 2,55 ммоль/л
Причины повышенного уровня кальция
Повышение уровня общего кальция – это гиперкальциемия. Две ее самые распространенные причины – гиперпаратиреоз (увеличение паращитовидных желез) и злокачественные новообразования.
Гиперпаратиреоз обычно вызван доброкачественной опухолью паращитовидных желез.
Онкообразования приводят к гиперкальциемии после поражения костной системы. Они выделяют вещество, подобное паратиреоидному гормону, и тем самым ведут к выходу кальция в кровяное русло.
Некоторые другие причины гиперкальциемии:
гипертиреоз,
саркоидоз,
туберкулез,
продолжительная неподвижность,
переизбыток витамина D,
заболевания системы крови (лимфома, лейкоз, миеломная болезнь, истинная полицитемия),
пересадка почки,
дегидратация,
болезнь Аддисона,
болезнь Педжета.
Причины пониженного уровня кальция
Самая частая причина гипокальциемии, уменьшения количества общего кальция, – снижение содержания белков в крови, особенно альбуминов. При этом снижен только уровень связанного кальция, ионизированный остается в норме и обмен кальция продолжает регулироваться паратиреоидным гормоном и кальцитонином.
Некоторые другие причины гипокальциемии:
гипопаратиреоз (снижение функции паращитовидных желез),
врождённая устойчивость к воздействию паратиреоидного гормона (от паратгормона нет эффекта, или он значительно снижен),
недостаток кальция в рационе,
недостаток магния (гипомагниемия),
недостаток витамина D,
повышение концентрации фосфора,
спру, острый панкреатит, алкоголизм (нарушение всасывания нутриентов и, как следствие, недостаток ферментов и субстратов для многих видов обмена),
хроническая почечная недостаточность.
Что может влиять на результат?
У некоторых людей уровень кальция повышается из-за определенных препаратов: щелочных антацидов, андрогенов, тиазидных диуретиков (самая частая причина), эргокальциферола, солей лития, прогестерона, парат-гормона, тамоксифена, витаминов D и A.
Другие лекарства, напротив, способны вызывать снижение концентрации кальция в крови: гентамицин, кальцитонин, антиконвульсанты (карбамазепин), глюкокортикоиды, слабительные, соли магния.
Кроме того, на результаты данного анализа влияют следующие факторы:
ложнозавышенные значения из-за дегидратации или гиперпротеинемии,
ложносниженные значения из-за гиперволемии (излишнего разведения крови) после внутривенного введения физраствора.
Важные замечания
У новорождённых, особенно недоношенных и с дефицитом массы тела, в первые дни жизни ежедневно берут кровь для анализа на ионизированный кальций в целях раннего выявления гипокальциемии. Она может возникнуть из-за недоразвитости паращитовидных желез, часто протекающей бессимптомно.
Концентрация кальция в крови и моче не говорит об общем содержании кальция в костях – для этого есть специальная методика определения минеральной плотности кости, называемая денситометрией.
Уровень кальция в крови обычно выше у детей и ниже у пожилых и беременных.
Уровень общего кальция в крови возрастает при увеличении концентрации альбуминов и снижается при ее уменьшении, в то время как содержание ионизированного кальция не зависит от их концентрации.
27. Магний в сыворотке (MAGNIUM)
Магний – жизненно важный минерал, участвующий в выработке энергии, мышечном сокращении, проведении нервного импульса, построении каркаса костей. Он поступает в организм из пищи, всасываясь в тонком и толстом кишечнике. Магний в основном сосредоточен в костях, клетках и тканях. В крови находится около 1 % от общего количества магния.
Организм поддерживает уровень магния, регулируя его всасывание в желудочно-кишечном тракте и выделение через почки.
Недостаток магния (гипомагниемия) может быть вызван излишней его потерей с мочой, нарушением питания, а также состояниями, сопровождающимися мальабсорбцией (нарушением всасывания). Избыток магния (гипермагниемия) иногда возникает после передозировки антацидами, содержащими его соединения, и при снижении выделительной функции почек. У людей с умеренным дефицитом этого минерала симптомы могут не проявляться. Длительная и сильная его нехватка чревата тошнотой, потерей аппетита, утомляемостью, спутанностью сознания, мышечными спазмами, онемением или покалыванием в конечностях. Симптомы избытка похожи на признаки недостатка и могут включать в себя еще тошноту, мышечную слабость и нарушение ритма сердца.
Уровень магния не проверяют так часто, как уровень других микроэлементов. В основном его измерение проводят при значительных изменениях уровня кальция и при указанных выше симптомах его нехватки.
Что означают результаты?
Возраст Референсные значения
< 5 мес. 0,62 — 0,91 ммоль/л
5 мес. — 6 лет 0,7 — 0,95 ммоль/л
6 — 12 лет 0,7 — 0,86 ммоль/л
12 — 20 лет 0,7 — 0,91 ммоль/л
> 20 лет 0,66 — 1,07 ммоль/л
Низкий уровень магния указывает на то, что человек недополучает магний с пищей, микроэлемент всасывается в недостаточном количестве либо выделяется в избытке с мочой. Это может быть связано с патологиями желудочно-кишечного тракта, вызывающими нарушение всасывания (например, болезнью Крона), неконтролируемым сахарным диабетом, гипопаратиреоидизмом, гипертиреозом, длительной диареей, послеоперационным периодом, длительным применением диуретиков, ожоговой болезнью, токсикозом, любым хроническим повышением образования альдостерона.
Высокий уровень магния редко связан с его избыточным употреблением с пищей, обычно он является результатом почечной недостаточности (нарушения механизмов выделения), гиперпаратиреоидизма (высвобождения магния из костей), гипотиреоза (недостатком кальцитонина), дегидратацией (сгущением крови), диабетическим кетоацидозом, болезнью Аддисона (недостатком минералкортикоидов), применением антацидов, содержащих соединения магния.
Что может влиять на результат?
Длительная внутривенная терапия, парентеральное питание, заместительная терапия препаратами крови или длительное назогастральное питание могут привести к ложному понижению концентрации магния.
Уровень магния часто снижается во втором и третьем триместре беременности.
Гипербилирубинемия влияет на концентрацию магния, приводя к ложному снижению результатов анализа.
Количество магния в организме может резко уменьшиться после операции на паращитовидной железе.
Лекарственные препараты, повышающие уровень магния: соли лития, ацетилсалициловая кислота, тироксин, эутирокс, прогестерон, триамтерен, витамин D (при хронической почечной недостаточности), цефотаксим, фоскарнет, гентамицин, галоперидол, преднизолон. Понижают концентрацию магния дигоксин, циклоспорин, диуретики (этакриновая кислота, фуросемид, гипотиазид), инсулин (большие дозы при диабетической коме), фенитоин, сальбутамол, альдостерон, амфотерицин B, соли кальция, цисплатин, слабительные (при хроническом злоупотреблении), пероральные контрацептивы.
Важные замечания
Нормальный уровень магния еще не означает, что у человека нет недостатка этого элемента. Концентрация магния в крови может поддерживаться в пределах нормы за счет высвобождения его из костей и тканей.
При гипокальциемии следует проверить концентрацию магния в крови.
28. Натрий в сыворотке (SODIUM)
Натрий – жизненно важный микроэлемент, который необходим для передачи импульсов в нервной системе и мышечных сокращений. Ион натрия взаимодействует с другими электролитами (калием, хлором, карбонат-анионом) и регулирует водно-солевой баланс организма. Вместе они обеспечивают нормальную работу нервных окончаний – передачу слабых электрических импульсов и, как следствие, сокращение мышц.
Натрий присутствует во всех жидкостях и тканях организма, но в наибольшей концентрации – в крови и во внеклеточной жидкости. Уровень внеклеточного натрия контролируется почками.
Для людей источник натрия – столовая соль. Большинство получает суточную норму этого элемента.
На всасывание натрия в кишечнике оказывают влияние гастрин, секретин, холецистокинин, простагландины. Организм забирает часть поступившего натрия на свои нужды, а остальное почки выделяют, поддерживая концентрацию электролита в очень узком диапазоне.
Механизмы поддержания натрия:
производство гормонов, которые повышают или понижают потерю натрия с мочой (натрийуретический пептид и альдостерон),
производство гормона, предупреждающего потерю жидкости с мочой (антидиуретический гормон),
контроль жажды (антидиуретический гормон).
Выходящая за пределы нормы концентрация натрия в крови обычно связана с одним из перечисленных механизмов. При изменении уровня натрия в крови меняется и количество жидкости в тканях организма. Чаще всего это приводит к обезвоживанию или отечности (особенно ног).
Из всех электролитов натрия в человеческом организме больше всего. Он играет главную роль в распределении жидкости между внеклеточным и внутриклеточным пространствами. Кроме того, он участвует в передаче нервного импульса и сокращении сердечной мышцы. Без определенного количества натрия организм не способен функционировать, поэтому так важно, чтобы его уровень был стабилен и не подвергался значительным колебаниям.
Натрий выделяется почками, а его концентрация регулируется гормоном альдостероном, синтезирующимся в надпочечниках. Другими факторами, поддерживающими натрий на постоянном уровне, являются активность фермента карбоангидразы, действие гормонов из передней доли гипофиза, секреция фермента ренина, АДГ, вазопрессин.
Что означают результаты?
Референсные значения: 136 — 145 ммоль/л.
Пониженный уровень натрия говорит о гипонатриемии, возникающей из-за чрезмерной потери электролита, избыточном поступлении жидкости в организм или ее задержке с отеками или без них.
Гипонатриемия редко возникает при недостатке поступления электролита извне. Наиболее часто она является следствием его возросшей потери (из-за болезни Аддисона, диареи, повышенного потоотделения, приема диуретиков или заболевания почек). Уровень натрия может снижаться в ответ на увеличение общего объема жидкости в организме (при чрезмерном потреблении воды, сердечной недостаточности, циррозе, заболеваниях почек, вызывающих чрезмерную потерю белка с мочой, например нефротическом синдроме). Иногда (особенно при заболеваниях головного мозга и легких, многих раковых поражениях и при употреблении некоторых лекарств) организм продуцирует много антидиуретического гормона, задерживающего жидкость в теле.
Высокий уровень натрия подразумевает гипернатриемию, в большинстве случаев возникающую из-за обезвоживания при недостаточном поступлении жидкости. Среди ее симптомов сухость слизистых, жажда, беспокойство, беспорядочные движения, судороги и кома. В редких случаях гипернатриемию вызывает синдром Кушинга или состояние с низким уровнем АДГ (несахарный диабет).
Причинами высокого уровня натрия могут быть кетоацидоз, синдром Кушинга, дегидратация, заболевание почек, несахарный диабет, большое поступление натрия, гиперальдостеронизм и др, низкого – постоянная жажда, сердечная недостаточность, рвота, диарея, несахарный диабет, цирроз, заболевания почек.
Снижение уровня натрия свидетельствует чаще о переизбытке жидкости, чем о нехватке натрия. Оно может быть вызвано:
застойной сердечной недостаточностью (отеками нижних конечностей и скоплением жидкости в естественных полостях организма),
чрезмерной потерей жидкости (тяжелой диареей, рвотой, сильным потоотделением),
введением гипертонического раствора глюкозы (накоплением жидкости в кровяном русле для разбавления получившегося состава крови),
тяжелым нефритом,
непроходимостью пилорического отдела желудка (рвотой желудочным содержимым с высоким содержанием электролитов),
мальабсорбцией – нарушением первичного всасывания натрия, поступающего с пищей, и адсорбцией натрия, выделившегося в просвет ЖКТ,
диабетическим ацидозом,
передозировкой лекарственных препаратов, например диуретиков (повышенным выделением электролита с мочой),
отеками,
большим поступлением жидкости,
гипотиреозом,
повышенной выработкой АДГ (задержкой жидкости в организме),
надпочечниковой недостаточностью (нехваткой альдостерона, отвечающего за обратное всасывание натрия в почках),
ожоговой болезнью (разбавлением крови за счет межклеточной жидкости).
Уровень натрия повышается при следующих состояниях:
обезвоживание,
синдром и болезнь Кушинга (чрезмерная выработка кортикостероидов, повышающих содержание натрия в организме),
первичный и вторичный гиперальдостеронизм,
кома,
несахарный диабет (недостаток выработки антидиуретического гормона),
трахеобронхит.
Что может влиять на результат?
Недавно полученная травма, хирургическое вмешательство, шоковое состояние способствуют увеличению концентрации натрия.
На уровень натрия влияют многие лекарства. Повышают его анаболические стероиды, кортикостероиды, кальций, соединения фтора, андроген, эстрогены, метилдопа, слабительные, оральные контрацептивы, бикарбонат натрия, понижают – гепарин, сульфаты, диуретики, карбамазепин, трициклические антидепрессанты.
29 Калий в сыворотке(POTASSIUM)
Калий – это катион, взаимодействующий с другими электролитами: натрием, хлором, бикарбонатом; вместе они регулируют обмен воды в организме, сокращения мышц, обеспечивают проведение нервного импульса и поддерживают кислотно-основное равновесие. Выводится калий почками под контролем альдостерона, продуцируемого надпочечниками в ответ на выработку ангиотензина II и гиперкалиемию.
Электролит содержится в основном в клетках, только небольшая его часть находится во внеклеточной жидкости и в жидкой части крови (плазме), эта доля составляет 2 % от его общего содержания в организме. Концентрация калия в плазме очень мала, поэтому любые, даже небольшие, изменения будут иметь выраженные последствия. При значительном повышении или понижении его уровня здоровью человеку грозит опасность: от развития шока до формирования дыхательной недостаточности или нарушений сердечного ритма. Отклонения данного показателя от нормы могут нарушать передачу импульса в мышечной ткани и между нейронами, например сердечная мышца может утратить способность сокращаться.
Что означают результаты?
Референсные значения: 3,5 — 5,1 ммоль/л.
Повышенный уровень калия – гиперкалиемия – может указывать на:
острую или хроническую почечную недостаточность (нарушение концентрационной и выделительной функции почек),
болезнь Аддисона (недостаточную выработку минералкортикоидов, отвечающих за гормональную регуляцию уровня калия),
гипоальдостеронизм (альдостерон отвечает за выведение калия из организма),
обширное повреждение ткани (массивный выход калия из клетки),
инфекционные заболевания,
сахарный диабет,
дегидратацию (происходит сгущение крови),
большое поступление калия с пищей, например с фруктами и овощами (бананами, грейпфрутами, апельсинами, помидорами, дыней, картофелем) или соками,
дефицит минералкортикоидов (АКТГ, кортизона и гидрокортизона),
гипорениновый гипоальдостеронизм.
Понижение концентрации калия встречается при таких патологических состояниях, как:
проблемы с ЖКТ (рвота, понос, передозировка слабительными, фистулы, синдром мальабсорбции), ведущие к потере из организма жидкости, богатой электролитами,
диабетический кетоацидоз,
первичный и вторичный гиперальдостеронизм,
синдром Барттера,
осмотический/постобструкционный диурез,
синдром Кушинга (повышенная выработка глюкокортикоидов, тормозящих реабсорбцию калия в почках),
недостаток поступления калия с пищей (редко).
Гипокалиемия может приводить к серьезным сердечным нарушениям: желудочковым экстрасистолам, пароксизмальной предсердной тахикардии, желудочковой тахикардии.
Что может влиять на результат?
Некоторые лекарственные препараты способствуют повышению уровня калия: нестероидные противовоспалительные средства, бета-блокаторы (пропранолол, атенолол), ингибиторы ангиотензин-превращающего фермента (каптоприл, эналаприл, лизиноприл), калийсберегающие диуретики (амилорид, триамтерен, спиронолактон), гепарин, гистамин, маннитол, литий.
У человека с диабетом уровень калия может снизиться после введения инсулина, особенно если заболевание долго оставалось бесконтрольным. Кроме того, недостаточная концентрация калия зачастую связана с приемом диуретиков. Вызывать снижение концентрации калия в крови способны и некоторые лекарства: глюкокортикостероиды, бета-агонисты (изопреналин), альфа-агонисты (клонидин), антибиотики (гентамицин, карбенициллин), противогрибковые (амфотерицин В).
К ложноповышенным результатам может приводить выраженный тромбоцитоз/лейкоцитоз.
30. Хлор в сыворотке(CHLORIDE)
Хлор – это электролит, отрицательно заряженная молекула, взаимодействующая с другими электролитами, такими как калий и натрий, и тем самым участвующая в регуляции количества жидкости в организме и поддерживающая кислотно-щелочной баланс. Этот анион находится во всех жидкостях тела, но в наибольшей концентрации – в крови и во внеклеточной жидкости. Как правило, изменения концентрации хлора подобны изменениям содержания натрия в организме: повышения и понижения возникают по схожим причинам. При нарушениях в кислотно-щелочном балансе концентрация хлора может меняться независимо от концентрации натрия, выступая как самостоятельная буферная система. Это помогает поддерживать постоянство биоэлектрического потенциала на клеточном уровне за счет движения заряженных молекул.
Хлор поступает в организм с едой и пищевой солью, состоящей из соединения натрия и, собственно, хлора. Большая часть хлора, всосавшегося в желудочно-кишечном тракте, выделяется с мочой. Хлор выделяется с другими катионами во время усиленного диуреза и теряется из ЖКТ во время рвоты, диареи или появления кишечных фистул. Уровень хлора в организме обычно постоянен, хотя немного снижается после приема пищи (в ответ на повышенное выделение во время еды соляной кислоты, частично состоящей из хлора).
При метаболическом ацидозе во время поднятия концентрации хлора уровень бикарбоната снижается. Подобным образом выработка альдостерона напрямую вызывает повышение обратного всасывания натрия и косвенно влияет на всасывание хлора.
Что означают результаты?
Референсные значения: 98 — 107 ммоль/л.
Изменения уровня хлора должны всегда учитываться вместе с концентрацией других электролитов, особенно натрия и бикарбоната. Повышение содержания хлоридов влечет за собой повышение уровня натрия или понижение уровня бикарбоната.
Причины повышения уровня хлора в сыворотке:
обезвоживание или другие состояния, отличительной чертой которых является повышение уровня натрия, например синдром Кушинга, заболевания почек, эклампсия,
большая потеря щелочей из организма (при метаболическом ацидозе) или гипервентиляционные нарушения, вызывающие респираторный алкалоз,
продолжительная рвота или нарушение всасывания в желудке,
диарея,
обширный ожог,
тепловой удар,
эмфизема и другие хронические заболевания легких, вызывающие респираторный ацидоз,
излишняя потеря кислот из организма (метаболический алкалоз),
первичный гиперпаратиреоидизм,
некоторые почечные нарушения (ацидоз почечных канальцев),
несахарный диабет (недостаток выработки АДГ),
травма головы с поражением гипоталамуса (нарушение общего гормонального статуса).
Причины понижения уровня хлора в сыворотке:
тяжелая многократная рвота (потеря хлоридов, продуцируемых в составе соляной кислоты),
нарушение всасывания в желудке,
хронический респираторный ацидоз,
обширные ожоги (разбавление крови за счет межклеточной жидкости),
метаболический алкалоз,
застойная сердечная недостаточность (отеки нижних конечностей и скопление жидкости в естественных полостях организма),
болезнь Аддисона (недостаточная выработка альдостерона, отвечающего за обратное всасывание хлора в почках),
язвенный колит (чрезмерная потеря жидкости с электролитами),
синдром неадекватной секреции антидиуретического гормона,
гипергидратация,
большое поступление жидкости (водная интоксикация),
острая перемежающаяся порфирия,
воспалительные заболевания почек с потерей солей.
Что может влиять на результат?
Некоторые лекарственные вещества могут повышать уровень хлора: андрогены, эстрогены, препараты кортизона, НПВС. Снижают его концентрацию глюкокортикоиды, диуретики (триамтерен, диакарб, гипотиазид).
31. Креатинкиназа (CREATIN KINASE) — это фермент, который катализирует реакцию переноса фосфорильного остатка с АТФ на креатин с образованием креатинфосфата и АДФ. АТФ (аденозинтрифосфат) – молекула, являющаяся источником энергии в биохимических реакциях человеческого организма.
Реакция, катализируемая креатинкиназой, обеспечивает энергией мышечные сокращения. Различают креатинкиназу, содержащуюся в митохондриях и цитоплазме клеток.
Молекула креатинкиназы состоит из двух частей, которые могут быть представлены одной из двух субъединиц: М, от английского muscle – «мышца», и B, brain – «мозг». Таким образом, в организме человека креатинкиназа есть в виде трех изомеров: ММ, МВ, ВВ. ММ-изомер содержится в скелетной мускулатуре и миокарде, МВ – в основном в миокарде, ВВ – в тканях головного мозга, в небольшом количестве в любых клетках организма.
В крови здорового человека креатинкиназа присутствует в небольших количествах, в основном в виде ММ-изомера. Активность креатинкиназы зависит от возраста, пола, расы, мышечной массы и физической активности.
Поступление креатинкиназы в кровоток в больших количествах происходит при повреждении содержащих ее клеток. При этом по повышению активности определенных изомеров можно сделать вывод о том, какая ткань поражена: ММ-фракция – повреждение мышц и в меньшей степени поражение сердца, МВ-фракция – повреждение миокарда, ВВ-фракция – онкологические заболевания. Обычно делают анализы на общую креатинкиназу и ее МВ-фракции.
Таким образом, повышение креатинкиназы в крови позволяет сделать вывод об опухолевом процессе, поражении сердца или мышц, которое в свою очередь может развиться как при первичном повреждении данных органов (при ишемии, воспалении, травмах, дистрофических процессах), так и вследствие их поражения при других состояниях (из-за отравления, метаболических нарушений, интоксикаций).
Сердечные заболевания, при которых разрушаются клетки, – это инфаркт миокарда, миокардиты, миокардиодистрофии, токсическое поражение миокарда. Анализ на креатинкиназу имеет наибольшее значение для диагностики инфаркта миокарда, так как активность этого фермента повышается раньше других, уже через 2-4 часа после инфаркта, и достигает максимума через 1-2 суток, затем нормализуется. Чем раньше начато лечение инфаркта, тем лучше для пациента, поэтому так важна своевременная и точная диагностика.
Заболевания мышц, при которых разрушаются клетки, – это миозиты, миодистрофии, травмы, особенно при сдавливании, пролежни, опухоли, интенсивная работа мышц, в том числе происходящая при судорогах. Кроме того, отмечена обратная зависимость уровня гормонов щитовидной железы и креатинкиназы: при снижении T3 и T4 активность креатинкиназы повышается и наоборот.
Интересно, что впервые анализ на креатинкиназу был использован для выявления миопатии, однако в настоящее время его используют главным образом для диагностики инфаркта миокарда.
Что означают результаты?
Возраст, пол Референсные значения
2 — 5 дней < 652 Ед/л
5 дней — 6 мес < 295 Ед/л
6 — 12 мес < 203 Ед/л
1 — 3 года < 228 Ед/л
3 — 6 лет < 149 Ед/л
6 — 12 лет женский < 154 Ед/л
6 — 12 лет мужской < 247 Ед/л
12 — 17 лет женский < 123 Ед/л
12 — 17 лет мужской < 270 Ед/л
> 17 лет женский < 167 Ед/л
> 17 лет мужской < 190 Ед/л
Результаты анализа говорят о наличии или отсутствии поражения миокарда, скелетной мускулатуры, опухолевого процесса, заболеваний щитовидной железы. Верная трактовка полученных показателей позволяет сделать вывод о форме поражения и степени его тяжести.
Причины повышения активности креатинкиназы общей:
инфаркт миокарда,
миокардиты,
миокардиодистрофии,
полимиозит,
дерматомиозит,
мышечные дистрофии,
травмы, ожоги,
гипотиреоз,
опухолевый процесс в организме,
распад опухоли,
прием дексаметазона, статинов, фибратов, амфотерицина В, обезболивающих, алкоголя, кокаина,
интенсивная физическая нагрузка,
судороги, эпилептический статус,
оперативные вмешательства.
Причины понижения активности креатинкиназы общей:
снижение мышечной массы,
алкогольное поражение печени,
коллагенозы (например, ревматоидный артрит),
гипертиреоз,
прием аскорбиновой кислоты, амикацина, аспирина,
беременность.
Что может влиять на результат?
Необходимо сообщать врачу точную информацию о принимаемых лекарствах, а также об имеющихся хронических заболеваниях.
Оперативные вмешательства и в некоторых случаях внутривенные инъекции повышают активность креатинкиназы.
Важные замечания
Повышение активности креатинкиназы общей не является прямым указанием на какое-либо заболевание, так что оно должно трактоваться специалистом с учетом клинической картины и результатов дополнительного обследования.
32. С-реактивный белок (CRP)
С-реактивный белок – это гликопротеин, вырабатываемый печенью и относящийся к белкам острой фазы воспаления. Под действием противовоспалительных цитокинов (интерлейкина-1, фактора некроза опухолей – альфа и в особенности интерлейкина-6) его синтез увеличивается уже через 6 часов, а концентрация в крови возрастает в 10-100 раз в течение 24-48 часов после начала воспаления. Наиболее высокие уровни СРБ (более 100 мг/л) наблюдаются при бактериальной инфекции. При вирусной инфекции уровень СРБ, как правило, не превышает 20 мг/л. Концентрация СРБ также повышается при некрозе тканей (в том числе при инфаркте миокарда, опухолевых некрозах).
СРБ участвует в активации комплемента (группы белков, являющихся частью иммунитета), моноцитов, стимулировании экспрессии молекул адгезии ICAM-1, VCAM-1, Е-селектина на поверхности эндотелия (они обеспечивают взаимодействие клеток), связывании и модификации липидов низкой плотности (ЛПНП), то есть способствует развитию атеросклероза. По результатам последних исследований, вялотекущее воспаление в стенке сосудов играет главную роль в развитии атеросклероза, что, в свою очередь, ассоциировано с возникновением сердечно-сосудистых заболеваний. Повреждению стенки сосудов, воспалению и повышению СРБ способствуют «классические» факторы риска сердечно-сосудистых заболеваний: курение, ожирение, снижение чувствительности тканей к действию инсулина.
Несколько повышенный базовый уровень СРБ, который может быть определен только благодаря высокочувствительным аналитическим методам, отражает активность воспаления во внутренней оболочке сосудов и является достоверным признаком атеросклероза. Некоторые исследования указывают на то, что пациенты с повышенным СРБ и нормальными ЛПНП имеют больший риск развития сердечно-сосудистых заболеваний, чем пациенты с нормальным СРБ и высокими ЛПНП. Относительно повышенный уровень СРБ даже при нормальном уровне холестерина у практически здоровых лиц позволяет прогнозировать риск возникновения гипертонической болезни, инфаркта миокарда, инсульта, внезапной сердечной смерти, сахарного диабета 2-го типа и облитерирующего атеросклероза периферических сосудов. У больных ишемической болезнью сердца чрезмерное содержание СРБ является плохим признаком и свидетельствует о высоком риске повторного инфаркта, инсульта, рестеноза при ангиопластике и осложнений после аортокоронарного шунтирования.
Уровень СРБ в крови снижают ацетилсалициловая кислота и статины, которые уменьшают активность воспаления в стенке сосудов и течения атеросклероза. Регулярная физическая нагрузка, умеренность в употреблении алкоголя, а также нормализация массы тела приводят к снижению уровня СРБ и, соответственно, риска сосудистых осложнений.
Как известно, среди причин смертности взрослого населения развитых стран сердечно-сосудистые заболевания и их осложнения занимают первое место. Исследования уровня СРБ в совокупности с другими показателями помогают оценить вероятный риск развития сердечно-сосудистых заболеваний у относительно здоровых людей, а также спрогнозировать течение болезни у пациентов кардиологического профиля, что может применяться в профилактических целях и при планировании тактики лечения.
Что означают результаты?
Референсные значения: 0 — 1 мг/л.
Концентрация СРБ меньше 1 мг/л указывает на низкий риск развития сердечно-сосудистых заболеваний и их осложнений, 1-3 мг/л – средний риск, больше 3 мг/л – высокий риск сосудистых осложнений у практически здоровых лиц и у больных с сердечно-сосудистыми заболеваниями.
Если уровень СРБ превышает 10 мг/л, проводят повторный тест и дополнительное обследование, чтобы выявить инфекционные и воспалительные заболевания.
СРБ больше 10 мг/л свидетельствует об остром воспалении, хроническом заболевании, травме и т. д.
Причины повышения уровня С-реактивного белка:
острые вирусные и бактериальные инфекции;
обострение хронических воспалительных (инфекционных и иммунопатологических) заболеваний;
повреждение тканей (травма, хирургическое вмешательство, острый инфаркт миокарда);
злокачественные новообразования и метастазы;
ожоги;
сепсис;
хронический вялотекущий воспалительный процесс, связанный с повышенным риском сердечно-сосудистых заболеваний и их осложнений;
курение;
артериальная гипертензия;
избыточная масса тела;
сахарный диабет;
атерогенная дислипидемия (снижение концентрации холестерина ЛПВП, увеличение концентрации триглицеридов, холестерина ЛПНП);
нарушение гормонального фона (повышение содержания эстрогенов и прогестерона).
Что может влиять на результат?
Факторы, повышающие уровень СРБ:
беременность, интенсивные физические нагрузки;
прием пероральных контрацептивов, заместительная гормональная терапия.
Факторы, снижающие уровень СРБ:
прием нестероидных противовоспалительных препаратов (аспирина, ибупрофена), кортикостероидов, статинов, бета-блокаторов.
Важные замечания
Оценивать базовый уровень СРБ целесообразно не ранее чем через 2 недели после исчезновения симптомов любого острого заболевания (или обострения хронического заболевания). При значительном повышении СРБ более 10 мг/л необходимо дополнительное обследование для уточнения причин воспалительного процесса.
33. Ревматоидный фактор (RHEUMATOID FACTORS II)
Ревматоидный фактор – аутоиммунное антитело, иммуноглобулиновый белок (IgM), производимый иммунной системой организма. Аутоантитела атакуют собственные ткани, ошибочно принимая их за чужеродные. Хотя природа ревматоидного фактора еще мало изучена, его присутствие является индикатором воспалительных и аутоиммунных процессов.
Анализ на ревматоидный фактор незаменим для подтверждения диагнозов «ревматоидный артрит» и «синдром Шегрена» (положительный результат в 75 % и 60-70 % случаев соответственно). Однако с его помощью можно выявить ряд других заболеваний, например хронические бактериальные, вирусные и паразитарные инфекции и некоторые разновидности рака. Кроме того, он может указывать на заболевания легких, печени и почек.
Что означают результаты?
Референсные значения: < 14 МЕ/мл.
Для того чтобы поставить диагноз «ревматоидный артрит», «синдром Шегрена», результат теста на ревматоидный фактор необходимо интерпретировать в сочетании с наблюдаемыми симптомами и клинической историей болезни.
При симптомах ревматоидного артрита высокий уровень ревматоидного фактора, вероятно, указывает на ревматоидный артрит. Если же у пациента есть еще и симптомы синдрома Шегрена, то значительная концентрация ревматоидного фактора может свидетельствовать и о его наличии. Однако даже отрицательный результат анализа не исключает того, что у пациента эти заболевания.
В то же время положительный результат анализа может быть зафиксирован и у здоровых пациентов либо страдающих, например, не ревматоидным артритом или синдромом Шегрена, а эндокардитом, системной красной волчанкой, туберкулезом, сифилисом, саркоидозом, раком, вирусной инфекцией или же болезнями печени, легких и почек.
34. Антистрептолизин О (ANTISTREPTOLYSIN O)
Антистрептолизин О (АСЛ О) – это вырабатываемые организмом антитела, направленные против стрептолизина О – токсического фермента, который выделяется некоторыми группами гемолитического стрептококка.
Бетагемолитический стрептококк группы А (Streptococcus pyogenes) – бактерия, которая вызывает стрептококковую ангину, скарлатину, стрептококковый фарингит, инфекцию кожи. В большинстве случаев стрептококковая инфекция имеет характерную клиническую картину, распознается и лечится антибиотиками, в результате чего микроб уничтожается. Если инфекция протекает атипично, не подвергается лечению или лечится неэффективно, то возрастает риск постстрептококковых осложнений – ревматической лихорадки и гломерулонефрита. Обычно это происходит у детей после ангины или скарлатины. Подобные осложнения стрептококковой инфекции не являются частыми, однако о них следует помнить.
Ревматическая лихорадка может проявляться повышением температуры, покраснением кожи вокруг суставов и их припухлостью, болью в области сердца, одышкой, утомляемостью, а гломерулонефрит – лихорадкой, болью в пояснице, уменьшением количества выделяемой мочи и ее покраснением. Ревматическая лихорадка приводит к развитию пороков сердца, гломерулонефрит – к почечной недостаточности и повышению артериального давления.
Так как симптомы этого заболевания могут сопровождать и другие состояния, анализ на антистрептолизин О позволяет выяснить, вызваны ли они стрептококковой инфекцией. Уровень АСЛ О повышается через неделю после инфицирования, достигает максимума через 3-6 недель и снижается через полгода-год.
Что означают результаты?
Возраст Референсные значения
До 14 лет 0 — 150 МЕ/мл
Старше 14 лет 0 — 200 МЕ/мл
Антитела к стрептолизину О начинают вырабатываться организмом через 1-2 недели после заражения стрептококковой инфекцией. Максимальной их концентрация в крови становится через 4-6 недель. Они могут сохраняться в крови в течение нескольких месяцев.
Отрицательный результат теста на антистрептолизин О или его очень низкая концентрация в крови с высокой вероятностью исключает недавнюю стрептококковую инфекцию. Особенно если через 10-14 дней после этого анализ вновь отрицательный. Только у небольшого количества лиц постстрептококковые осложнения не сопровождаются подъемом АСЛ О.
Повышенный АСЛ О (до четырех норм и выше) или нарастание его титра свидетельствует о недавно перенесенной стрептококковой инфекции. Снижение уровня АСЛ О говорит о выздоровлении пациента после инфекции.
Тем не менее по степени повышения АСЛ О нельзя судить о том, возникнут ли ревматическая лихорадка и гломерулонефрит и какова будет степень их тяжести. Однако при наличии симптомов этих заболеваний повышение АСЛ О позволяет подтвердить диагноз.
Помимо этого, уровень антистрептолизина О может быть повышен при реактивном артрите.
Что может влиять на результат?
Ложноотрицательные результаты могут наблюдаться при нефротическом синдроме, а также лечении кортикостероидами и некоторыми антибиотиками.
К завышенным показателям приводят гиперхолестеринемия и заболевания печени.
Важные замечания
Небольшое увеличение АСЛ О, как правило, говорит о давно перенесенной стрептококковой инфекции. О недавнем заражении свидетельствуют очень высокие значения АСЛ О.
При подозрении на стрептококковую инфекцию верхних дыхательных путей (при фарингите или тонзиллите) необходимо взятие мазка с последующим посевом на гемолитический стрептококк группы А.
Так как АСЛ О начинает появляться в крови только через 1-2 недели, его нельзя использовать для диагностики острой инфекции.
35. Ферритин сыворотки крови – белок, в форме которого в основном запасается железо в организме.
Оно всасывается из пищи и затем переносится трансферрином – специальным белком, который образуется в печени. Железо необходимо для образования эритроцитов и является важнейшей частью гемоглобина – белка, заполняющего эритроциты и позволяющего им переносить кислород от легких к органам и тканям. Кроме того, оно входит в состав мышечного белка миоглобина и некоторых ферментов.
В норме в организме содержится 4-5 граммов железа. Около 70 % от этого количества составляет как раз железо, «встроенное» в гемоглобин эритроцитов. Оставшееся главным образом запасается в тканях в составе белковых комплексов – ферритина и гемосидерина, – которые в основном содержатся в печени, а также в костном мозге, селезенке и мышцах. Хотя в крови ферритин присутствует в небольших количествах, его концентрация отражает запасы железа в организме.
Когда железа начинает не хватать, например в случае уменьшения приема его с пищей или частых кровотечений, организм начинает использовать резерв из тканей. Количество ферритина при этом, соответственно, уменьшается. Длительная нехватка поступающего железа может привести к анемии. Уровень ферритина же бывает сниженным задолго до появления симптомов железодефицита и позволяет вовремя диагностировать анемию.
С другой стороны, если железа поступает слишком много, это может приводить к его чрезмерному накоплению и, как следствие, к поражению печени, сердца и поджелудочной железы.
Стоит отметить, что использование разных анализов, отражающих обмен железа в организме, дает более полную и достоверную информацию о недостатке или переизбытке этого микроэлемента, чем только тест на ферритин.
Что означают результаты?
Возраст Референсные значения
1-2 месяца 200 — 600 мкг/л
2-5 месяцев 50 — 200 мкг/л
5 месяцев – 15 лет 7 — 140 мкг/л
Мужчины старше 15 лет 20 — 250 мкг/л
Женщины старше 15 лет 10 — 120 мкг/л
Причины понижения уровня ферритина
Дефицит железа, в том числе скрытый. Снижение ферритина ниже 10 нг/мл, как правило, говорит о железодефицитной анемии.
Третий триместр беременности. Уменьшение количества железа в таком случае является нормальным.
Причины повышения уровня ферритина
Наследственный гемохроматоз. При этом заболевании из пищи всасывается слишком много железа, которое откладывается в различных органах, вызывая их повреждение.
Множественные переливания крови, введение железа внутримышечно, назначение таблетированных препаратов железа.
Воспаления, например инфекции верхних дыхательных путей, мочевыводящих путей, аутоиммунные заболевания. Причем повышение ферритина в острой фазе воспаления может маскировать имеющийся дефицит железа.
Острые или хронические заболевания печени.
Алкоголизм.
Гемолитические анемии: связанные с разрушением эритроцитов, B12-дефицитная анемия, талассемия.
Гипертиреоз – повышение функции щитовидной железы.
Онкологические заболевания костного мозга, рак молочной железы, болезнь Ходжкина – злокачественное новообразование лимфоидной ткани. Уровень ферритина при этом будет повышен значительно.
Что может влиять на результат?
К ложноповышенному результату могут приводить:
голодание,
алкоголь, эстрогены, оральные контрацептивы, препараты железа.
Недавнее использование радиофармпрепаратов делает результат анализа недостоверным.
Уровень ферритина повышается с возрастом.
При интенсивной физической нагрузке концентрация ферритина увеличивается.
Важные замечания
Организм в норме теряет железо за счет слущивания клеток кожи, а также с калом и потом. Для восполнения этих потерь требуется, чтобы с пищей поступало не менее 1 мг железа в день, женщинам во время менструации – в два раза больше. Нормальное сбалансированное питание обеспечивает поступление 10-15 мг железа в день, всасывается около 10 % от этого количества. Основные источники железа в пище: мясо, рыба, зелень и крупы.
Уровень ферритина остается нормальным, если нехватка железа сопровождается воспалением. Поэтому для выявления дефицита железа в такой ситуации может использоваться совместное назначение анализов на ферритин и трансферрин.
36. Витамин В12
Определение концентрации витамина В12 в сыворотке крови – стандартный метод диагностики его дефицита.
Витамин В12 содержится исключительно в продуктах животного происхождения, таких как мясо (особенно печень и почки), рыба, яйца, молочные продукты. В последние годы важным источником витамина В12, особенно для вегетарианцев, стали обогащенные им каши, хлеб, сухие завтраки и другие зерновые продукты.
В12 важен для синтеза нуклеиновых кислот, образования эритроцитов, клеточного и тканевого обмена, к тому же он участвует в поддержании нормального функционирования нервной системы. Дефицит витамина В12 может привести к развитию макроцитарной (мегалобластной) анемии. Основным ее проявлением является уменьшение количества эритроцитов в крови, но увеличение при этом их размера – образование макроцитов. Макроциты, как правило, имеют более короткую продолжительность жизни по сравнению с нормальными эритроцитами и больше склонны к гемолизу, что приводит к усталости, слабости и другим симптомам анемии. Недостаток витамина В12 грозит поражением нервной системы (фуникулярным миелозом), которое проявляется в виде покалывания в ногах и руках пациента (дистальные парестезии), расстройстве чувствительности, повышении сухожильных рефлексов.
Основные причины дефицита витамина В12 в организме
Недостаточное поступление. В12 накапливается преимущественно в печени и селезенке. Так как запасы этого витамина в организме достаточно велики, а выведение происходит медленно, для создания значимого дефицита требуется около 5 лет недостаточного поступления его в организм. Соответственно, группами риска являются голодающие люди и вегетарианцы.
Нарушение всасывания. Дефицит В12 иногда возникает при различных заболеваниях тонкой кишки, нарушающих всасывание этого витамина (целиакии, болезни Крона, снижении кислотности желудочного сока (ахлоргидрии), а также при уменьшении реабсорбирующей поверхности после резекции тощей кишки. Однако наиболее частая причина дефицита В12 – пернициозная анемия. В основе этого заболевания лежит врождённая неспособность желудка секретировать вещество, необходимое для всасывания витамина В12 в кишечнике.
Нарушение утилизации. Различные заболевания печени и почек, а также злоупотребление алкоголем приводит к снижению накопления и увеличению выделения витамина В12.
Увеличение потребности организма в витамине. При различных заболеваниях, требующих большого количества витамина В12, например гемолитической анемии, гипертиреозе и альфа-талассемии.
Что означают результаты?
Референсные значения: 191 — 663 пг/мл.
Снижение концентрации витамина B12 с большой вероятностью указывает на его дефицит, но не обязательно отражает уровень тяжести анемии или нейропатии.
Повышение уровня витамина В12 обычно клинически не контролируется. Оно может происходить при лейкемии или нарушении функции печени.
Причины снижения уровня витамина В12
Пернициозная анемия – заболевание, обусловленное нарушением кроветворения из-за недостатка в организме витамина B12. В его основе лежит врождённая неспособность желудка секретировать внутренний фактор – вырабатываемое добавочными клетками желудка комплексное соединение, необходимое для усвоения витамина В12 в кишечнике.
Потеря витамина при глистных инвазиях (широком лентеце).
Беременность (чаще в последнем триместре).
Полная или частичная гастроэктомия.
Атрофический гастрит.
Воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенный колит, регионарный энтерит).
Болезни кишечника, сопровождающиеся нарушением всасывания (целиакия, спру).
Врождённое отсутствие транскобаламина-2, из-за которого нарушается всасывание и транспортировка витамина В12.
Туберкулез подвздошной кишки.
Лимфома тонкой кишки.
Причины повышения уровня витамина В12
Острая и хроническая миелогенная лейкемия.
Болезни печени (острый и хронический гепатит, цирроз, печеночная кома). Нарушение депонирования витамина В12 в печени.
Истинная полицитемия – злокачественное заболевание кроветворной системы, сопровождающееся гиперплазией клеточных элементов костного мозга и увеличением уровня сывороточного витамина В12.
Что может влиять на результат?
Уровень витамина В12 понижается при его недостатке в пище (вегетарианстве) и злоупотреблении алкоголем.
Оральные контрацептивы, колхицин, противосудорожные препараты, антибиотики понижают концентрацию В12.
Если при одновременном дефиците витамина В12 и фолиевой кислоты пациент получает только препараты фолиевой кислоты, уровень витамина В12 может быть нормальным или повышенным.
Важные замечания
При подозрении на дефицит В12 необходимо провести тест на фолиевую кислоту, так как зачастую их уровни взаимосвязаны.
Уровень витамина В12 может повышаться при неправильном лечении препаратами витамина В12.
37. ФОЛИЕВАЯ КИСЛОТА (Витамин B9)
В9 – водорастворимый витамин. Впервые он был выделен из листьев шпината, но уже за 20 лет до этого была установлена роль печени и дрожжей в терапии мегалобластической анемии – состояния, развивающегося при дефиците В9.
Витамин В9 поступает в организм с пищей. Он содержится в бобах, петрушке, салате, капусте, томатах, шпинате, спарже, печени, почках, мясе, грибах, дрожжах и разрушается при высоких температурах. Часть витамина В9 вырабатывается микрофлорой кишечника в присутствии парааминобензойной кислоты. Кроме того, в печени и почках есть запасы фолацина, которые могут компенсировать недостаточное его поступление в течение нескольких месяцев.
В9 всасывается в тонком кишечнике: в его слизистой происходят биохимические превращения витамина с образованием активных форм, способных проходить в кровь и участвовать в биохимических реакциях. Роль В9 в организме состоит в его способности переносить метильный остаток (СН3-) – это реакции, в ходе которых образуются ДНК и некоторые аминокислоты (глицин, метионин).
При гиповитаминозе синтез ДНК замедляется и появляются аномальные ДНК, которые легко распадаются из-за замены тиминовых нуклеотидов уридиновыми. При таком нарушении в первую очередь страдают клетки и ткани, которые часто обновляются, – кровь и эпителий, – что и определяет симптомы гиповитаминоза фолиевой кислоты.
Развивается мегалобластическая анемия, которая проявляется бледностью, слабостью, утомляемостью, в анализе крови видны атипичные клетки. Вдобавок снижается количество других элементов крови – тромбоцитов и лейкоцитов – и появляются их аномальные формы.
Другая ткань, страдающая при нехватке В9, – это эпителий: медленнее заживают раны, страдает желудочно-кишечный тракт – уменьшается выработка необходимых для пищеварения ферментов, развивается глоссит (поражение языка), эзофагит (поражение пищевода), гастрит, энтерит.
Важно различать мегалобластическую анемию, вызванную дефицитом фолатов, от той, что вызвана дефицитом витамина В12. При второй большие дозы фолатов способны скорректировать нарушения в крови пациента, но неврологические осложнения прогрессируют.
Кроме образования ДНК, витамин В9 участвует в производстве метионина из гомоцистеина. При гиповитаминозе количество гомоцистеина увеличивается, что повышает вероятность сердечно-сосудистых заболеваний.
Достаточный уровень фолатов в организме снижает риск развития онкологических заболеваний и играет особую роль при беременности, особенно на ранних сроках, – у плода происходит интенсивное деление клеток, закладываются будущие органы и ткани, особенно важна правильная закладка нервной трубки. Нарушение этих процессов приводит к порокам развития: к отклонениям нервной системы (анэнцефалии, гидроцефалии, спинномозговым грыжам), к нарушению формирования конечностей, к порокам сердца. Кроме того, дефицит В9 при беременности может вызывать неправильное формирование плаценты и даже прерывание беременности.
В сутки человеку нужно 25 мкг В9, однако потери при всасывании увеличивают количество, которое должно поступить с пищей, до 50 мкг. Потребность в В9 возрастает при беременности и кормлении грудью, а также при злокачественных опухолях, некоторых видах гемолитических анемий и кожных заболеваний.
Важно помнить, что неустойчивость витамина к кулинарной обработке может приводить к его недостатку в пище. К тому же вероятно развитие гиповитаминоза при нарушении всасывания – из-за злоупотребления спиртными напитками и кислыми продуктами, приема некоторых лекарств (барбитуратов, фенитоина), синдрома мальабсорбции.
При этом переизбыток В9 крайне маловероятен, так как, будучи водорастворимым, витамин выводится с мочой.
Что означают результаты?
Референсные значения: 7 — 39,7 нмоль/л.
Причины повышения уровня В9:
передозировка препаратов, содержащих витамин В9 (поливитаминов, мамифола, фолиевой кислоты, фолацина).
Причины понижения уровня В9:
недостаточное поступление витамина с пищей (голодание, преимущественное употребление пищи, прошедшей кулинарную обработку),
плохое усвоение В9 в кишечнике,
повышенная потребность в витамине В9 (беременность, грудное вскармливание, гемодиализ, онкологические заболевания).
Что может влиять на результат?
Перед анализом необходимо учесть факт приема препаратов витамина В9.
38. ГОМОЦИСТЕИН
Гомоцистеин – серосодержащяя аминокислота, которая является продуктом обмена аминокислот метионина и цистеина. Гомоцистеин обычно содержится в клетках организма в очень небольших концентрациях. Метионин является одной из одиннадцати незаменимых аминокислот, то есть таких, которые не образуются в организме и поступают в него только с пищей. В здоровых клетках гомоцистеин быстро трансформируется в продукты своего обмена.
Для дальнейшего метаболизма гомоцистеина необходимы витамины B6, B12 и фолиевая кислота. У пациентов, испытывающих их недостаток, уровень гомоцистеина может быть повышен.
Избыток гомоцистеина опасен развитием атеросклероза из-за повреждения стенок кровеносных сосудов и формирования кровяных сгустков, хотя между этими двумя событиями и нет прямой связи. Целесообразность использования показателей гомоцистеина для того, чтобы оценить риск возникновения сердечно-сосудистых заболеваний, болезней периферических сосудов и инсультов, сомнительна, поскольку, согласно данным клинических исследований, введение фолиевой кислоты и витаминов группы В в организмы больных не снижало количество сердечно-сосудистых заболеваний среди них.
Уровень гомоцистеина в крови и в моче может резко возрастать при гомоцистеинурии – редкой болезни, передающейся по наследству. Она является причиной изменений в одном или нескольких генах. У страдающего от гомоцистеинурии человека формируется дефектный фермент, который не позволяет осуществлять расщепление метионина. Из-за этого в организме накапливается гомоцистеин и метионин. Ребенок, родившийся с гомоцистеинурией, выглядит здоровым первое время после рождения, однако через несколько лет у него проявляются признаки болезни: смещаются глазные линзы, ребенок становится высоким и худым, а его пальцы – длинными и тонкими, он начинает страдать аномалиями скелета, остеопорозом, кроме того, у него сильно повышается риск возникновения тромбоза и атеросклероза, что может привести к ранним сердечно-сосудистым заболеваниям. Дальнейшее развитие болезни грозит задержкой умственного развития, отклонениями в поведении и эпилепсией.
Что означают результаты?
Возраст Референсные значения, мкмоль/л
< 15 лет < 10
15-65 лет < 15
> 65 лет < 20
Беременность < 10
Уровень гомоцистеина может быть повышенным при недоедании либо при нехватке витамина В12 и фолиевой кислоты. В этом случае организм не может превращать гомоцистеин в вещества, усвояемые организмом, поэтому содержание гомоцистеина в крови повышается.
Сильно повышенный уровень гомоцистеина у новорождённого указывает на большую вероятность того, что у ребенка гомоцистеинурия, так что необходимы дальнейшие анализы для подтверждения диагноза.
Важные замечания
Если результаты анализов подтверждают гомоцистеинурию, производится биопсия тканей печени и кожи для выявления фермента цистатионин-бета-синтазы. Его отсутствие – наиболее частая причина гомоцистеинурии. Иногда, если упациента имеется генетическая предрасположенность к раннему атеросклерозу либо у кого-то из членов его семьи диагностировалась гомоцистеинурия, назначаются генетические анализы для проверки на мутации.
Уровень гомоцистеина повышается с возрастом, а также если пациент курит либо принимает лекарства (карбамазепин, метотрексат или фенитоин). У женщин концентрация гомоцистеина возрастает после менопаузы, вероятно, благодаря уменьшению выработки эстрогенов.
39. Витамин D, 25-гидрокси (кальциферол) (25-OH)
Витамин D – жирорастворимое вещество, необходимое для поддержания в крови уровня кальция, фосфора и магния. По своему действию он является гормоном и антирахитическим фактором. Существует несколько форм витамина D, которые можно определить в крови: 25-гидроксивитамин D [25(OH)D] и 1,25-дигидроксивитамин D [1,25(OH)(2)D]. 25-гидроксивитамин D – основная неактивная форма гормона, содержащегося в крови, предшественник активного гормона 1,25-дигидроксивитамина D. Для определения количества витамина D обычно используется 25-гидроксивитамин D из-за его высокой концентрации и длительного периода полураспада.
По происхождению витамин D бывает двух типов: эндогенный (холекальциферол), который образуется в коже под влиянием солнечных лучей, и экзогеннный (эргокальциферол), который поступает в организм вместе с пищей. Пищевые источники витамина D: жирная рыба (например, лосось, скумбрия), рыбий жир. В основном витамин D является продуктом превращения 7-дегидрохолестерола, образующегося в коже под воздействием ультрафиолетового излучения с длиной волны 290-315 нм. Синтез витамина D зависит от длительности воздействия и интенсивности излучения. Переизбытка кальциферола при этом не возникает, так как существуют фоточувствительные защитные механизмы, которые метаболизируют лишний витамин D в тахистерол и люмистерол. В печени витамин D превращается в 25-гидроксикальциферол, который и является основным лабораторным показателем уровня витамина D в организме. В крови данная форма витамина транспортируется в комплексе с белком. В почках 25-ОН-D превращается в биологически активную форму витамина D – 1,25-дигидроксикальциферол (1,25-ОН(2)-D), который стимулирует всасывание кальция в кишечнике и реабсорбцию кальция и фосфора в почках.
При дефиците витамина D уровень кальция компенсируется за счет его мобилизации из костной ткани, что может привести к остеомаляции, рахиту у детей и остеопорозу у взрослых. По данным некоторых исследований, дефицит витамина D также ассоциирован с аутоиммунными заболеваниями, раком простаты, раком молочных желез, раком толстой кишки, гипертонией, заболеваниями сердца, множественным склерозом, сахарным диабетом 1-го типа. Риск развития дефицита витамина D высокий у людей с нарушениями всасывания питательных веществ в кишечнике (например, при болезни Крона, внешнесекреточной недостаточности поджелудочной железы, муковисцидозе, целиакии, состояний после резекции желудка и кишечника), заболеваниями печени, нефротическим синдромом. Пожилые люди, жители северных широт и люди, избегающие солнечного света, также страдают недостатком витамина D. Поэтому нередко детям и взрослым с риском дефицита витамина D назначают препараты с эрго- или холекальциферолом.
Однако чрезмерное употребление препаратов витамина D имеет негативные последствия. Его избыток токсичен, может вызвать тошноту, рвоту, задержку роста и развития, повреждение почек, нарушение обмена кальция и работы иммунной системы. В связи с этим важен контроль уровня витамина D в крови, своевременная диагностика его дефицита или переизбытка.
Что означают результаты?
Референсные значения: 30 — 100 нг/мл.
Причины пониженного уровня 25-гидроксивитамина D:
нехватка солнечного света;
недостаточное потребление витамина D с пищей;
нарушение всасывания витамина D из кишечника при синдроме мальабсорбции;
нефротический синдром (в связи с повышенной потерей жидкости и белка);
заболевания печени (нарушение одного из этапов метаболизма витамина D);
прием некоторых лекарственных препаратов (например, фенитоина, который влияет на способность печени производить 25-гидроксивитамин D).
Повышенный уровень 25-гидроксивитамина D:
чрезмерное употребление препаратов, содержащих витамин D.
Что может влиять на результат?
Лекарственные препараты, снижающие уровень 25-гидроксикальциферола в крови: фенитоин, фенобарбитал, рифампицин, пероральные антикоагулянты.
Беременность.
№ 2
1. Общий анализ крови Клинический (blood chemistry with CBC)
Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений) – это один из наиболее часто выполняемых анализов в медицинской практике. Сегодня это исследование автоматизировано и позволяет получить подробную информацию о количестве и качестве клеток крови: эритроцитов, лейкоцитов и тромбоцитов. С практической точки зрения врачу в первую очередь следует сосредоточить свое внимание на следующих показателях этого анализа:
Hb (hemoglobin) – гемоглобин;
MCV (mean corpuscular volume) – средний объем эритроцита;
RDW (RBC distribution width) – распределение эритроцитов по объему;
Общее количество эритроцитов;
Общее количество тромбоцитов;
Общее количество лейкоцитов;
Лейкоцитарная формула – процентное соотношение разных лейкоцитов: нейтрофилов, лимфоцитов, моноцитов, эозинофилов и базофилов;
Скорость оседания эритроцитов, СОЭ. Показатель СОЭ зависит от соотношения белковых фракций крови и количества эритроцитов.
Определение показателей клинического анализа крови позволяет диагностировать такие состояния, как анемия/полицитемия, тромбоцитопения/тромбоцитоз и лейкопения/лейкоцитоз, которые могут как являться симптомами какого-либо заболевания, так и выступать в качестве самостоятельных патологий.
При интерпретации анализа следует учитывать следующие особенности:
У 5 % здоровых людей показатели анализа крови отклоняются от принятых референсных значений (границ нормы). С другой стороны, у пациента может быть выявлено значительное отклонение от его обычных показателей, которые при этом сохраняются в пределах принятых норм. По этой причине результаты теста должны интерпретироваться в контексте индивидуальных обычных показателей каждого конкретного человека.
Показатели крови зависят от расы и пола. Так, у женщин количество и качественные характеристики эритроцитов ниже, а количество тромбоцитов выше, чем у мужчин. Для сравнения: нормы у мужчин – Hb 12,7-17,0 г/дл, эритроциты 4,0-5,6×1012/л, тромбоциты 143-332×109/л, нормы у женщин – Hb 11,6-15,6 г/дл, эритроциты 3,8-5,2×1012/л, тромбоциты 169-358×109/л. Кроме того, гемоглобин, нейтрофилы и тромбоциты ниже у темнокожих людей, чем у людей белой расы.
2. Обследование щитовидной железы (Thyroid Panel — should include: T3, Free T3, rT3, T4, Thyroid AB)
Щитовидная железа – жизненно важный эндокринный орган, который состоит из двух долей, соединенных перешейком, и расположен на передней поверхности шеи ниже хрящей гортани. Она синтезирует, накапливает и секретирует в кровь тиреоидные гормоны – трийодтиронин (Т3) и тироксин (Т4), которые регулируют метаболические, энергетические и теплообменные процессы в организме. Данные гормоны вырабатываются в фолликулах щитовидной железы при участии йодидов и аминокислоты тирозина. 90 % от их общего количества составляет тироксин (Т4), который в тканях превращается в потенциально более активный трийодтиронин. В крови Т4 транспортируется в двух формах – связанной (в комплексе с тиреоид-связывающим белком) и свободной (несвязанной).
Свободный Т4 является биологически активной фракцией гормона. Уровень секреции тиреоидных гормонов контролируется гипоталамо-гипофизарной системой и зависит от поступления йода в организм. При снижении концентрации в крови гормонов Т4 и Т3 стимулируется гипоталамус и секретируется тиреолиберин (тиреотропин-рилизинг-гормон), который, в свою очередь, увеличивает продукцию тиреотропного гормона (ТТГ) в гипофизе. ТТГ усиливает синтез и секрецию тиреоидных гормонов щитовидной железой. Когда концентрация тироксина и трийодтиронина в крови увеличивается, продукция ТТГ в центральных эндокринных органах замедляется по принципу обратной связи. Данные механизмы в норме поддерживают в организме эутиреоз (нормальный уровень гормонов щитовидной железы).
При патологии щитовидной железы или гипоталамо-гипофизарной системы изменяется (повышается или понижается) уровень тиреоидных гормонов, что нарушает обменные процессы, как следствие, могут поражаться многие органы и системы организма. Повышенный уровень тироксина и трийодтиронина в крови – лабораторный признак гиперфункции щитовидной железы (гипертиреоза, тиреотоксикоза). Гипертиреоз проявляется учащенным сердцебиением, потерей массы тела, раздражительностью и нервозностью, тремором рук, экзофтальмом, нарушением сна. При сниженной продукции гормонов щитовидной железы (гипотиреозе) отмечается брадикардия, увеличение массы тела, сухость кожи, выпадение волос, запоры, зябкость, утомляемость, заторможенность, депрессия. Тяжелый гипотиреоз – микседема – может стать причиной сердечной недостаточности и комы. У детей он приводит к кретинизму – задержке физического и умственного развития.
Нарушение функции щитовидной железы (гипотиреоз или тиреотоксикоз) чаще наблюдается у женщин, чем у мужчин. Нередко такая патология впервые проявляется во время беременности, в период новорождённости или в 40-50 лет.
Учитывая тесную связь щитовидной железы с работой нервной, сердечно-сосудистой, репродуктивной и других систем организма, нарушение ее функции без своевременной диагностики и адекватного лечения может привести к миокардиту, сердечной недостаточности, бесплодию и неврологическим нарушениям.
Важные замечания
При изменениях уровня ТТГ и Т4 свободного необходимо дальнейшее обследование, чтобы уточнить причины и механизмы патологического процесса.
Нормальный уровень ТТГ и Т4 свободного не позволяет полностью исключить нарушение функции щитовидной железы. Возможен вариант синдрома эутиреоидной патологии.
Если результаты анализа указывают на эндокринное заболевание и щитовидная железа увеличена, необходимо дополнительное лабораторное и инструментальное (УЗИ) обследование под контролем лечащего врача.
3. Лабораторное обследование функции печени (Liver Profile )
Печень – это самая крупная железа в организме человека. Этот орган выполняет около 5 000 разных функций. Основные функции печени можно оценить с помощью комплексного лабораторного исследования.
1. Синтетическая функция печени
Альбумин – основной белок крови, выполняющий транспортную функцию и обеспечивающий поддержание онкотического давления. При нарушении синтетической функции печени концентрация этого белка, как правило, снижается. Следует отметить, что это снижение наблюдается при тяжелом течении заболеваний печени, например при фульминантном гепатите и тяжелой печеночной недостаточности. Напротив, при торпидно или латентно протекающих заболеваниях печени (гепатит С, алкогольный гепатит) уровень общего белка может оставаться в пределах нормы. Кроме того, изменение концентрации альбумина может наблюдаться и при многих других заболеваниях и состояниях, например голодании, мальабсорбции, нефротическом синдроме, инфекционных заболеваниях и др.
Протромбин по Квику (другое название – протромбиновое время) и международное нормализованное соотношение (МНО, INR) – основные показатели, используемые для оценки внешнего пути свертываемости крови (фибриногена, протромбина, фактора V, VII и X). Печень является основным источником синтеза этих факторов, а заболевания этого органа могут сопровождаться нарушением механизма коагуляции и приводить к повышенной кровоточивости. Следует, однако, отметить, что клинически значимые нарушения коагуляции крови наблюдаются на поздних стадиях заболеваний печени.
Холестерин может быть синтезирован практически в любой клетке организма, однако большая его часть (до 25 %) синтезируется в печени, откуда это соединение поступает в системный кровоток в составе липопротеинов очень низкой плотности (ЛПОНП) или в желудочно-кишечный тракт в составе желчных кислот. Гиперхолестеринемия является характерной чертой печеночного холестаза, наблюдающегося при желчнокаменной болезни, первичном склерозирующем холангите, вирусном гепатите, первичном билиарном циррозе и некоторых других заболеваниях. Гипохолестеринемия имеет меньшее клиническое значение. Различные фракции холестерина ассоциированы с различными эффектами на здоровье человека. Так, холестерин в составе липопротеинов низкой плотности (ХС-ЛПНП) – хорошо известный фактор риска заболеваний сердца, в то время как ХС ЛПВП считается одним из защитных факторов.
2. Обменная функция печени
АЛТ и АСТ – ферменты, необходимые для метаболизма аминокислот. Хотя эти ферменты также могут быть обнаружены во многих других тканях и органах (сердце, скелетные мышцы, почки, головной мозг, эритроциты), изменение их концентрации в крови чаще связано с заболеваниями печени, что обуславливает их название – печеночные трансаминазы. АЛТ является более специфичным маркером заболеваний печени, чем АСТ. При вирусных гепатитах и токсическом поражении печени, как правило, наблюдается одинаковое повышение уровня АЛТ и АСТ. При алкогольном гепатите, метастазах в печень и циррозе печени наблюдается более выраженное повышение АСТ, чем АЛТ.
Щелочная фосфатаза, ЩФ, – еще один ключевой фермент печени, катализирующий перенос фосфатных групп между различными молекулами. Уровень ЩФ определяют при подозрении на холестаз: концентрация общей ЩФ повышена практически в 100 % случаев внепеченочной обструкции желчных путей. Кроме гепатоцитов, щелочная фосфатаза присутствует в костной ткани и клетках кишечника, а повышение общей ЩФ может наблюдаться не только при поражении печени, но и при других заболеваниях (заболевания костной ткани, инфаркт миокарда, саркоидоз).
Гамма-глютамилтранспептидаза, гамма-ГТ, – фермент печени, катализирующий перенос гамма-глутамильной группы глутатиона на другие молекулы. В настоящий момент гамма-ГТ – это самый чувствительный маркер заболеваний печени. Повышение концентрации гамма-ГТ может наблюдаться при всех заболеваниях печени, однако наибольшее значение этого маркера заключается в диагностике обструкции желчных путей. При обструкции желчных путей концентрация гамма-ГТ повышается в 5-30 раз. Исследование уровня гамма-ГТ позволяет убедиться в том, что повышение общей ЩФ вызвано именно заболеванием печени, а не другими причинами, в первую очередь заболеваниями костной системы. Как правило, при обструкции желчных путей наблюдается параллельное повышение уровня гамма-ГТ и общей ЩФ. Высокие уровни гамма-ГТ характерны для метастатического поражения и алкогольного цирроза печени. При вирусных гепатитах отмечается умеренное повышение уровня гамма-ГТ (в 2-5 раз).
3. Экскреторная функция печени
Билирубин – пигмент, образующийся при распаде гемоглобина и некоторых других гемсодержащих белков в печени, селезенке и костном мозге. Он проявляет токсичность в отношении нервной системы и должен быть удален из организма с желчью или с мочой. Экскреция билирубина – многоступенчатый процесс, в котором печень играет главную роль. Различают две основные фракции билирубина: прямой и непрямой билирубин. При связывании билирубина с глюкуроновой кислотой в печени образуется связанный билирубин. Так как этот вид билирубина можно определить напрямую, с помощью непосредственного лабораторного теста, он также называется прямым билирубином. Билирубин, который не подвергся конъюгации с глюкуроновой кислотой, называется несвязанным. В лабораторных условиях определить уровень несвязанного билирубина не удается: его концентрацию рассчитывают, исходя из концентраций общего и связанного билирубина. По этой причине этот вид билирубина также называют непрямым. Общий билирубин состоит из обеих фракций. Увеличение уровня билирубина может наблюдаться при многих заболеваниях печени, однако наибольшее значение этого маркера заключается в дифференциальной диагностике желтух. Для гемолитической (надпеченочной) желтухи характерно увеличение общего и непрямого билирубина. Для печеночной желтухи типично повышение обеих фракций (прямого и непрямого билирубина) и общего билирубина. Для обструктивной (подпеченочной) желтухи характерно увеличение общего и прямого билирубина.
В это комплексное исследование включены показатели, позволяющие оценить основные функции печени. В некоторых ситуациях, однако, могут потребоваться дополнительные тесты. Повторные анализы рекомендуется выполнять с помощью одних и тех же тест-систем, то есть в одной и той же лаборатории.
4. ИНСУЛИН (INSULIN)
Инсулин синтезируется в бета-клетках эндокринной части поджелудочной железы. Его концентрация в крови напрямую зависит от концентрации глюкозы: после приема пищи в кровь попадает большое количество глюкозы, в ответ на это поджелудочная железа секретирует инсулин, который запускает механизмы перемещения глюкозы из крови в клетки тканей и органов. Также инсулин регулирует биохимические процессы в печени: если глюкозы становится много, то печень начинает запасать ее в виде гликогена (полимера глюкозы) или использовать для синтеза жирных кислот. Когда синтез инсулина нарушен и его вырабатывается меньше, чем необходимо, глюкоза не может попасть в клетки организма и развивается гипогликемия. Клетки начинают испытывать недостаток в основном субстрате, требующемся им для образования энергии, – в глюкозе. Если такое состояние является хроническим, то нарушается обмен веществ и начинают развиваться патологии почек, сердечно-сосудистой, нервной систем, страдает зрение. Заболевание, при котором наблюдается недостаток выработки инсулина, называется сахарным диабетом. Он бывает нескольких типов. В частности, тип первый развивается, когда поджелудочная железа не вырабатывает достаточное количество инсулина, тип второй связывают с потерей чувствительности клеток к воздействию на них инсулина. Второй тип наиболее распространен. Для лечения сахарного диабета на начальных этапах обычно используют специальную диету и препараты, которые либо усиливают выработку инсулина поджелудочной железой, либо стимулируют клетки организма к потреблению глюкозы за счет увеличения их чувствительности к данному гормону. В случае если поджелудочная железа совсем перестает продуцировать инсулин, требуется его введение с инъекциями. Повышенная концентрация инсулина в крови называется гиперинсулинемией. При этом содержание глюкозы в крови резко снижается, что может привести к гипогликемической коме и даже к смерти, так как от концентрации глюкозы напрямую зависит работа головного мозга. Поэтому очень важно контролировать уровень сахара при парентеральном введении препаратов инсулина и других лекарств, использующихся для лечения диабета. Повышенный уровень инсулина в крови также бывает обусловлен опухолью, секретирующей его в больших количествах, – инсулиномой. При ней концентрация инсулина в крови может повышаться в десятки раз в течение короткого времени. Заболевания, связанные с развитием сахарного диабета: метаболический синдром, патология надпочечников и гипофиза, синдром поликистозных яичников.
Что означают результаты?
Референсные значения: 2,6 — 24,9 мкЕд/мл.
Причины повышенного уровня инсулина:
акромегалия,
синдром Иценко – Кушинга,
фруктозная или глюкозо-галактозная непереносимость,
инсулинома,
ожирение,
невосприимчивость к инсулину, как при хроническом панкреатите (включая муковисцидоз) и при раке поджелудочной железы.
Что может влиять на результат?
Употребление таких препаратов, как кортикостероиды, леводопа, оральные контрацептивы, способствует повышению концентрации глюкозы.
Важные замечания
В настоящее время в качестве инъекций применяют инсулин, полученный в результате биохимического синтеза, что делает его наиболее сходным по своей структуре и свойствам с эндогенным (вырабатывающимся в организме) инсулином.
Антитела к инсулину могут сказаться на результатах исследования, поэтому при их наличии в крови рекомендуется использовать альтернативные методы определения концентрации инсулина (анализ на С-пептид).
5. Гистамин в цельной крови(Whole blood Histamine)
Гистамин – небольшая молекула, которая образуется в организме человека из аминокислоты гистидина и относится к классу биогенных аминов. Гистамин выполняет функции «посредника» (медиатора) в реализации аллергических реакций.
При развитии аллергической реакции происходит связывание аллергена (к которому ранее произошла сенсибилизация) с молекулами иммуноглобулина E. Комплекс антиген-антитело связывается с Fc-рецепторами на мембране базофилов и тучных клеток.
В результате внутрь клеток передается активирующий сигнал и происходит их дегрануляция: высвобождение гистамина и факторов воспаления из внутриклеточных гранул тучной клетки или базофила в кровь или окружающие ткани.
Выделившийся гистамин нестабилен и, выполнив свою функцию, через 15-25 секунд начинает расщепляться (окисляется и трансметилируется) ферментами гистаминазой и гистамин-N-метилтрансферазой до N-метилимидазолуксусной кислоты и N-метилгистамина соответственно. А через 15-30 минут происходит его полная утилизация. Поэтому определение гистамина в плазме крови не имеет клинической ценности.
В гранулах иммунных клеток стабильность и накопление гистамина поддерживается за счет образования комплексов с белками. Большая часть содержащегося в цельной крови гистамина содержится в базофилах крови и всегда готово высвободиться при развитии аллергической реакции.
Количество гистамина в цельной крови зависит от числа базофилов и запаса медиаторов в их гранулах, поэтому результат лабораторного анализа этих запасов может быть прогностическим маркером силы и выраженности клинических проявлений аллергической реакции у конкретного пациента.
6. Цинк в крови (ZINC)
Цинк — это микроэлемент, необходимый для нормального роста и дифференцировки клеток.Он является кофактором более чем 200 ферментов (трансферазы, гидролазы, изомеразы), входит в состав некоторых транскрипционных факторов (так называемые цинковые пальцы) и стабилизирует мембраны клеток. В основном человек получает цинк с пищей, наиболее богаты этим микроэлементом мясные, молочные и морепродукты, а также крупы, орехи и овощи. Всасывание цинка происходит в двенадцатиперстной и тощей кишке. Некоторые компоненты пищи (например, белки животного происхождения) способствуют всасыванию цинка, и, наоборот, фитиновая кислота и железо препятствуют его активной абсорбции. Суточная потребность в цинке зависит от возраста и физиологического состояния организма: для взрослого мужчины рекомендуемая норма составляет 11 мг в сутки, для взрослой женщины – 8 мг. Беременным женщинам, кормящим матерям, детям и подросткам необходимо до 12-15 мг цинка в сутки. Как дефицит, так и избыток цинка оказывают неблагоприятное воздействие на функционирование многих систем и органов. Для оценки баланса цинка в организме, диагностики его недостаточности или интоксикации им исследуют его концентрацию в крови. Считается, что уровень цинка в крови наиболее точно отражает его запасы в организме.
Дефицит цинка описан при некоторых редких врождённых болезнях обмена (энтеропатический акродерматит) и проявляется характерными изменениями кожи, алопецией и диареей. Клинически выраженная алиментарная недостаточность цинка встречается достаточно редко. С другой стороны, субклинический дефицит этого микроэлемента может быть диагностирован у каждого третьего человека. Недостаток цинка чаще всего встречается в период активного роста, наибольшую потребность в нем наблюдается в возрасте 10-12 лет у девочек и 11-14 лет у мальчиков. Субклинический дефицит цинка в период полового созревания может стать причиной нарушения роста осевого скелета и минерализации костной ткани. Кроме того, недостаточность цинка встречается у пациентов, находящихся на полном парентеральном питании, а также пациентов с хроническими заболеваниями. Повторные исследования концентрации цинка в крови проводят для оценки лечения дефицита этого микроэлемента при назначении цинксодержащих препаратов. Следует, однако, отметить, что низкий уровень цинка в крови не всегда означает нехватку этого микроэлемента в организме. Концентрация цинка в крови понижается при острых инфекционно-воспалительных процессах, травмах, интенсивных физических нагрузках и стрессе. В норме уровень этого элемента снижается в постпрандиальный период (после еды).
Интоксикация цинком может наблюдаться при употреблении напитков из оцинкованных емкостей. Основными признаками острого алиментарного отравления цинком являются тошнота, боль в области живота, диарея, лихорадка и повышенная потливость. Хронический избыток цинка иногда сопровождается нарушением всасывания меди. Рабочие, занятые на производстве, связанном с выработкой или применением цинка, подвержены риску острого ингаляционного отравления его парами, этот синдром называется «металлической лихорадкой» и обусловлен острым токсическим воздействием паров оксидов металлов на верхние и нижние дыхательные пути. Острое отравление сопровождается лихорадкой, кашлем, болью в горле, ощущением заложенности носа, одышкой, слабостью, миалгией. При исследовании крови у таких пациентов иногда удается выявить повышение концентрации цинка. Следует отметить, что симптомы «металлической лихорадки» не являются специфичными для острого отравления парами оксида цинка и наблюдаются также при вдыхании паров алюминия, марганца, меди, железа, свинца и других металлов. Таким образом, исследование уровня цинка (а также и других металлов) в крови может быть использовано при диагностике профессиональных болезней. При этом повышение концентрации цинка в крови не всегда является признаком отравления, так, например, оно наблюдается и при длительном голодании.
Интерпретировать результат анализа необходимо с учетом дополнительных клинических, лабораторных и инструментальных исследований.
Что означают результаты?
Референсные значения: 543 — 1130 мкг/л.
Причины повышения уровня цинка в крови:
острое или хроническое отравление цинком;
анемия;
артериолосклероз;
первичная остеосаркома;
прием глюкокортикостероидов, цисплатина, эстрогенсодержащих препаратов, фенитоина и тиазидов.
Причины понижения уровня цинка в крови:
энтеропатический акродерматит;
алкоголизм;
алопеция;
целиакия;
диарея;
заболевания желчного пузыря;
метастатическое поражение печени;
гипоальбуминемия;
инфекционно-воспалительные заболевания;
лейкоз и лимфома;
инфаркт миокарда;
беременность (3-й триместр);
полное парентеральное питание;
хроническая почечная недостаточность;
стресс;
талассемия;
туберкулез;
гепатолентикулярная дегенерация;
прием химиотерапевтических препаратов, эстрогенсодержащих препаратов, цисплатина, гистидина и пеницилламина.
Что может влиять на результат?
Концентрация цинка в норме снижается в постпрандиальный период (после еды).
Инфекционно-воспалительные заболевания, травмы, стресс, интенсивные физические нагрузки влияют на уровень цинка в крови.
Важные замечания
Уровень цинка в крови наиболее точно отражает его запасы в организме;
результат анализа следует интерпретировать с учетом дополнительных анамнестических (профессиональные вредности), клинических и лабораторных данных.
7. Медь в крови (COPPER)
Медь – важный катион, входящий в состав многих ферментов. Они принимают активное участие в метаболизме железа, формировании соединительной ткани, выработке энергии на клеточном уровне, продукции меланина (пигмента, отвечающего за цвет кожи) и в нормальном функционировании нервной системы.
Основными источниками меди для человека являются такие продукты питания как орехи, шоколад, грибы, печень, злаки и сухофрукты. Также медь может поступать в организм с водой, в случае, если она контактировала с медьсодержащими предметами (например с медьсодержащей посудой). После поступления в желудочно-кишечный тракт медь всасывается в тонкой кишке и соединяясь с белками крови, транспортируется в печень. Большая часть меди в крови находится в связанном с церрулоплазмином состоянии (около 95 %), меньшая часть связана с альбуминами сыворотки или находится в свободном состоянии. При избыточном поступлении меди с пищей печень выделяет ее излишки с желчью и она удаляется из организма с калом и мочой.
Недостаточность меди, как и ее избыток — редкие патологичсекие состояния. Чаща встречается перенасыщеие организма медью, связанное с нарушением ее обмена, либо хроническим отравлением. Наследственное заболевание, приводящее к повышенному отложению меди в тканях организма называется болезнь Вильсона-Коновалова (Уильсона-Коновалова). Основными его симптомами являются:
анемия
тошнота
рвота
боли в животе
желтуха
повышенная утомляемость
резкие перемены настроения
дрожание конечностей
нарушение глотания
неустойчивая походка
дистония
появление специфической окраски радужки глаз
При вовлечении в патологический процесс почек может нарушиться образование мочи вплоть до анурии. Некоторые из этих симптомов иногда также проявляются при остром или хроническом отравлении медью, возникающем из-за загрязнения окружающей среды, а также вследствие заболеваний печени, которые препятствуют обмену микроэлемента.
Дефицит меди может внезапно возникнуть у людей, страдающих заболеваниями, вызывающими тяжелую мальабсорбцию (муковисцидозом, целиакией). Эти болезни сопровождаются нейтропенией, остеопорозом и микроцитарной анемией.
Редкая генетическая патология, связанная с X-хромосомой, болезнь Менкеса («болезнь курчавых волос») ведет к дефициту меди у болеющих детей. Это заболевание, поражающее преимущественно мужчин, проявляется судорожными приступами, задержкой развития, дисплазией артерий головного мозга и необычно ломкими курчавыми волосами.
Недостаточное количество меди в крови грозит производством дефектных эритроцитов с низкой продолжительностью жизни, а также уменьшением активности ферментов, содержащих в своем составе этот микроэлемент.
Что означают результаты?
Для мужчин: 700 — 1400 мкг/л.
Для женщин: 800 — 1550 мкг/л.
Причины повышения уровня меди:
внутривенное введение медьсодержащих растворов,
применение оральных контрацептивов,
первичный билиарный цирроз,
хронические воспалительные заболевания (ревматоидный артрит, системная красная волчанка),
гемохроматоз,
гипертиреоз,
гипотиреоз,
лейкоз,
лимфома,
анемия (пернициозная, железодефицитная, апластическая).
Причины снижения уровня меди:
болезнь Менкеса («болезнь курчавых волос»),
болезнь Вильсона – Коновалова (гепатолентикулярная дегенерация),
заболевания желудочно-кишечного тракта (спру, целиакия, поражения тонкого кишечника),
заболевания почек и печени,
долгий период энтерального питания,
квашиоркор,
муковисцидоз,
нарушения обмена коллагена,
первичный остеопороз,
саркоидоз.
Результаты исследования должны оцениваться в комплексе с анализом на церулоплазмин и клиническими данными. Изолированное повышение концентрации меди в крови не является подтверждением наличия заболевания, а лишь указывает на необходимость дальнейшего клинического поиска.
Характерными лабораторными признаками болезни Вильсона – Коновалова являются снижение концентрации меди в крови, повышение ее концентрации в моче в сочетании с пониженным уровнем церулоплазмина.
При некоторых патологических состояниях, таких как хронические заболевания печени, почек, остром гепатите, наблюдается повышенное выделение меди с мочой и ее высокий уровень в крови, при этом уровень церулоплазмина будет нормальный или повышенный.
Уменьшение содержания меди в крови и в моче, а также уменьшение концентрации церулоплазмина иногда свидетельствуют о дефиците меди.
Повышение концентрации меди во время лечения состояния, связанного с ее дефицитом и снижением концентрации церулоплазмина, говорит об эффективности проводимой терапии.
Ситуации, вызывающие сильное изменение уровня меди, чаще всего связаны с нарушением питания и/или всасывания меди, а также с какими-либо генетическими нарушениями ее утилизации и включения в процессы обмена.
Что может влиять на результат?
Интерпретация результатов может быть осложнена тем, что церулоплазмин является белком острой фазы воспаления, поэтому его уровень повышен при любом воспалительном или инфекционном заболевании. Оба эти показателя возрастают во время беременности, в период приема эстрогенов и оральных контрацептивов.
Лекарственные препараты карбамазепин, фенобарбитал, эстрогены, оральные контрацептивы, фенитоин повышают уровень меди в крови, нифедипин снижает его.
8. Ферритин (Ferritin)
Ферритин – белок, в форме которого в основном запасается железо в организме.
Оно всасывается из пищи и затем переносится трансферрином – специальным белком, который образуется в печени. Железо необходимо для образования эритроцитов и является важнейшей частью гемоглобина – белка, заполняющего эритроциты и позволяющего им переносить кислород от легких к органам и тканям. Кроме того, оно входит в состав мышечного белка миоглобина и некоторых ферментов.
В норме в организме содержится 4-5 граммов железа. Около 70 % от этого количества составляет как раз железо, «встроенное» в гемоглобин эритроцитов. Оставшееся главным образом запасается в тканях в составе белковых комплексов – ферритина и гемосидерина, – которые в основном содержатся в печени, а также в костном мозге, селезенке и мышцах. Хотя в крови ферритин присутствует в небольших количествах, его концентрация отражает запасы железа в организме.
Когда железа начинает не хватать, например в случае уменьшения приема его с пищей или частых кровотечений, организм начинает использовать резерв из тканей. Количество ферритина при этом, соответственно, уменьшается. Длительная нехватка поступающего железа может привести к анемии. Уровень ферритина же бывает сниженным задолго до появления симптомов железодефицита и позволяет вовремя диагностировать анемию.
С другой стороны, если железа поступает слишком много, это может приводить к его чрезмерному накоплению и, как следствие, к поражению печени, сердца и поджелудочной железы.
Стоит отметить, что использование разных анализов, отражающих обмен железа в организме, дает более полную и достоверную информацию о недостатке или переизбытке этого микроэлемента, чем только тест на ферритин.
Что означают результаты?
Возраст Референсные значения
1-2 месяца 200 — 600 мкг/л
2-5 месяцев 50 — 200 мкг/л
5 месяцев – 15 лет 7 — 140 мкг/л
Мужчины старше 15 лет 20 — 250 мкг/л
Женщины старше 15 лет 10 — 120 мкг/л
Причины понижения уровня ферритина
Дефицит железа, в том числе скрытый. Снижение ферритина ниже 10 нг/мл, как правило, говорит о железодефицитной анемии.
Третий триместр беременности. Уменьшение количества железа в таком случае является нормальным.
Причины повышения уровня ферритина
Наследственный гемохроматоз. При этом заболевании из пищи всасывается слишком много железа, которое откладывается в различных органах, вызывая их повреждение.
Множественные переливания крови, введение железа внутримышечно, назначение таблетированных препаратов железа.
Воспаления, например инфекции верхних дыхательных путей, мочевыводящих путей, аутоиммунные заболевания. Причем повышение ферритина в острой фазе воспаления может маскировать имеющийся дефицит железа.
Острые или хронические заболевания печени.
Алкоголизм.
Гемолитические анемии: связанные с разрушением эритроцитов, B12-дефицитная анемия, талассемия.
Гипертиреоз – повышение функции щитовидной железы.
Онкологические заболевания костного мозга, рак молочной железы, болезнь Ходжкина – злокачественное новообразование лимфоидной ткани. Уровень ферритина при этом будет повышен значительно.
Что может влиять на результат?
К ложноповышенному результату могут приводить:
голодание,
алкоголь, эстрогены, оральные контрацептивы, препараты железа.
Недавнее использование радиофармпрепаратов делает результат анализа недостоверным.
Уровень ферритина повышается с возрастом.
При интенсивной физической нагрузке концентрация ферритина увеличивается.
Dажные замечания
Организм в норме теряет железо за счет слущивания клеток кожи, а также с калом и потом. Для восполнения этих потерь требуется, чтобы с пищей поступало не менее 1 мг железа в день, женщинам во время менструации – в два раза больше. Нормальное сбалансированное питание обеспечивает поступление 10-15 мг железа в день, всасывается около 10 % от этого количества. Основные источники железа в пище: мясо, рыба, зелень и крупы.
Уровень ферритина остается нормальным, если нехватка железа сопровождается воспалением. Поэтому для выявления дефицита железа в такой ситуации может использоваться совместное назначение анализов на ферритин и трансферрин.
9. Скорость оседания эритроцитов (СОЭ)(SED RATE)
Определение скорости оседания эритроцитов (СОЭ) – непрямой метод выявления воспалительного, аутоиммунного или онкологического заболевания. Оно проводится на образце венозной или капиллярной крови, в которую добавлено вещество, позволяющее ей не сворачиваться (антикоагулянт). При анализе СОЭ методом Панченкова кровь помещают в тонкую стеклянную или пластиковую пробирку и наблюдают за ней в течение часа. В это время эритроциты (красные кровяные клетки), как имеющие большую удельную массу, оседают, оставляя над собой столбик прозрачной плазмы. По расстоянию от верхней границы плазмы до эритроцитов и вычисляют показатель СОЭ. В норме эритроциты оседают медленно, оставляя совсем немного чистой плазмы. Для данного метода используется аппарат Панченкова, состоящий из штатива и капиллярных пипеток со шкалой 100 мм.
При капиллярной фотометрии (автоматические анализаторы ROLLER, TEST1) используется кинетический метод «остановленной струи». В начале анализа СОЭ происходит запрограммированное перемешивание пробы в целях дезагрегирования эритроцитов. Неэффективная дезагрегация или наличие микросгустков могут повлиять на конечный результат, т. к. анализатор фактически измеряет кинетику агрегации эритроцитов. При этом измерение происходит в диапазоне от 2 до 120 мм/ч. Результаты измерения СОЭ данным методом имеют высокую корреляцию с методом Вестергрена, являющимся эталонным для определения СОЭ в крови, и одинаковые с ним референсные значения.
Результаты, получаемые при использовании метода капиллярной фотометрии, в области нормальных значений совпадают с результатами, получаемыми при определении СОЭ методом Панченкова. Однако метод капиллярной фотометрии более чувствителен к повышению СОЭ, и результаты в зоне повышенных значений выше результатов, получаемых методом Панченкова.
Повышение уровня патологических белков, находящихся в жидкой части крови, а также некоторых других белков (так называемых острофазовых, появляющихся при воспалении) способствует «склеиванию» эритроцитов. Из-за этого они оседают быстрее и СОЭ повышается. Получается, что любое острое или хроническое воспаление может приводить к повышению СОЭ в крови.
Чем меньше эритроцитов, тем быстрее они оседают, поэтому у женщин СОЭ выше, чем у мужчин. Норма СОЭ различна в зависимости от пола и возраста.
Что означают результаты?
Пол Возраст Референсные значения
Мужской от 15 до 50 лет 2 — 15 мм/ч
старше 50 лет 2 — 20 мм/ч
Женский до 50 лет 2 — 20 мм/ч
старше 50 лет 2 — 30 мм/ч
Результаты данного анализа необходимо интерпретировать с учетом клинических данных, истории заболевания, а также других анализов.
Причины повышения СОЭ в крови
Инфекционные заболевания (чаще бактериальной причины). СОЭ может повышаться как при острых, так и при хронических инфекционных заболеваниях.
Воспалительные заболевания.
Болезни соединительной ткани (ревматоидный артрит, системная красная волчанка, системная склеродермия, васкулиты).
Воспалительные заболевания кишечника (болезнь Крона, неспецифический язвенный колит).
Онкологические заболевания:
Миеломная болезнь. Как правило, сопровождается очень высоким уровнем СОЭ в крови, потому что при ней в большом количестве синтезируются патологические белки, которые вызывают образование эритроцитарных «монетных столбиков».
Болезнь Ходжкина – злокачественное заболевание лимфатических узлов. Показатель СОЭ обычно используется не для постановки диагноза, а для контроля за течением и эффективностью лечения уже диагностированного заболевания.
Рак различных локализаций, особенно гемобластозы. Считается, что крайне высокий уровень СОЭ в крови свидетельствует о распространении опухоли за пределы первичного очага (т. е. о метастазах).
Инфаркт миокарда. При нем происходит повреждение сердечной мышцы, что вызывает системный воспалительный ответ и, соответственно, повышение СОЭ. После инфаркта СОЭ достигает пика примерно через неделю.
Анемии. Уменьшение количества эритроцитов может приводить к увеличению скорости их оседания.
Ожоги, травмы.
Амилоидоз – заболевание, связанное с накоплением в тканях патологического белка.
Причины снижения СОЭ в крови
Болезни, сопровождающиеся изменением формы эритроцитов, такие как серповидно-клеточная анемия или наследственный сфероцитоз (они затрудняют оседание эритроцитов).
Полицитемия (увеличение количества эритроцитов) и состояния, которые к ней приводят, такие как, например, хроническая сердечная недостаточность или заболевания легких.
Что может влиять на результат?
СОЭ у женщин, как правило, повышается во время беременности и менструации.
Оральные контрацептивы, теофиллин, прием витамина А могут увеличивать СОЭ.
Прием кортикостероидов и введение альбумина способны снижать показатель СОЭ в крови.
Важные замечания
Анализ СОЭ – один из наименее специфичных лабораторных тестов – повышение СОЭ в крови может наблюдаться при многих заболеваниях, и по одному этому показателю нельзя поставить диагноз.
Иногда высокая СОЭ может наблюдаться у здоровых людей.
Нормальный уровень СОЭ не исключает онкологического заболевания или болезней соединительной ткани.
10. Активированное частичное тромбопластиновое время (АЧТВ)(PTT)
Активированное частичное тромбопластиновое время (АЧТВ) характеризует внутренний путь свертывания крови. АЧТВ представляет собой время, за которое формируется сгусток в образце плазмы крови, после добавления к ней специальных активаторов этого процесса. Таким образом оценивается степень воздействия факторов свертывания крови на образование тромба.
Продолжительность АЧТВ зависит от уровня высокомолекулярного кининогена, прекалликреина и факторов свертывания XII, XI, VIII и менее чувствительно при изменениях количества факторов X, V, протромбина и фибриногена. АЧТВ определяют по длительности образования кровяного сгустка после добавления в пробу крови кальция и парциального тромбопластина. Увеличение длительности АЧТВ связано с повышенным риском кровотечений, уменьшение – с тромбозом. Данный показатель отдельно используют для контроля терапии прямыми антикоагулянтами (гепарином).
Что означают результаты?
Референсные значения: 21,1 — 36,5 сек.
Увеличение АЧТВ указывает на склонность к кровотечению: свертывание крови длится дольше обычного, что часто говорит о недостаточности одного из коагуляционных факторов или о воздействии какого-либо ингибитора на способность организма к тромбообразованию.
Что может влиять на результат?
Наличие примесей прямых антикоагулянтов (в частности, гепарина) в пробе крови
Высокая концентрация липидов (жиров) в крови, например, после употребления жирной пищи накануне исследования
11. Протромбиновое время (PT)
Протромбиновое время (ПТВ) и его производные протромбиновый индекс (ПТИ) и международное нормализованное отношение (МНО) — лабораторные показатели, определяемые для оценки внешнего пути свёртывания крови. Используются при оценке системы гемостаза в целом, эффективности терапии варфарином, степени нарушения печеночной функции (синтеза факторов коагуляции), степени насыщения витамином К. ПТВ позволяет оценить активность факторов свертывания I, II, V, VII и X. Зачастую определяется вместе с показателем активированное частичное тромбопластиновое время (АЧТВ), которое оценивает внутренний путь свертывания крови.
Нормальное значение
Нормальный показатель протромбинового времени — 11—16 секунд, для МНО — 0,85—1,35. При терапии пероральными антикоагулянтами (варфарином) требуется более высокий целевой уровень МНО — обычно в диапазоне 2—3.
Протромбиновое время — это время образования сгустка после добавления в плазму тканевого фактора (реагент получают из тканей животных). Данный показатель позволяет оценить внешний и общий пути свертывания крови. Скорость коагуляции крови по внешнему пути сильно зависит от концентрации VII фактора свертывания крови. VII фактор — белок с короткой продолжительностью жизни, для его синтеза необходим витамин К. ПТВ может быть удлинено в результате дефицита витамина К, возникающего при применении варфарина (желательный клинический эффект), при синдроме мальабсорбции, при недостаточной бактериальной колонизации кишечника (например у новорождённых). Кроме того недостаточная концентрация VII фактора может наблюдаться при заболеваниях печени (нарушение синтеза), или повышенном потреблении фактора (ДВС-синдром), что также удлиняет ПТВ. При МНО выше 5,0 — наблюдается высокий риск кровотечения, при МНО ниже 0,5 — высокий риск тромбообразования. Нормальные значения МНО у здоровых индивидуумов от 0,8 до 1,3. При терапии варфарином — целевой уровень МНО 2,0—3,0, хотя в отдельных случаях, например при наличии искусственного механического клапана сердца, в предоперационный период может потребоваться более высокий целевой уровень МНО.
12. Прогестерон (PROGESTERON)
Прогестерон является стероидным гормоном, чья основная функция состоит в подготовке организма женщины к беременности.
Каждый месяц эстроген заставляет внутренний выстилающий слой матки – эндометрий – расти и обновляться, в то время как лютеинизирующий гормон (ЛГ) способствует высвобождению яйцеклетки в одном из яичников. На месте высвободившейся яйцеклетки образуется так называемое желтое тело, которое вырабатывает прогестерон. Прогестерон вместе с гормоном, выделяемым надпочечниками, останавливает рост эндометрия и подготавливает матку к возможной имплантации оплодотворенной яйцеклетки.
Если оплодотворения не происходит, желтое тело исчезает, уровень прогестерона падает и наступает менструальное кровотечение. Если же оплодотворенная яйцеклетка прикрепляется к стенке матки, желтое тело продолжает производить прогестерон. Через несколько недель плацента берет на себя функцию желтого тела по выработке прогестерона, являясь основным источником данного гормона во время беременности.
Что означают результаты?
Фаза цикла, беременность Прогестерон, нмоль/л
Женщины Фолликулиновая 0,181 — 2,84
Овуляторная 0,385 — 38,1
Лютеиновая 5,82 — 75,9
Постменопауза < 0,40
1-й триместр 35 — 141
2-й триместр 80,8 — 264
3-й триместр 187 — 681
Мужчины < 0,47
Интерпретация результатов анализа зависит от причины его выполнения, а также от особенностей менструальных циклов пациентки или ее беременности. Уровень прогестерона обычно начинает возрастать, когда яйцеклетка выходит из яичника, далее повышается в течение нескольких дней, а затем либо продолжает расти с наступлением беременности, либо падает, давая сигнал к началу менструации.
Если концентрация прогестерона не меняется в течение каждого месяца, возможно, у пациентки не происходит овуляции либо нарушены менструальные циклы.
Когда уровень прогестерона не повышается должным образом на ранних сроках беременности, можно предположить внематочную либо патологическую беременность. Если серия анализов не показала его повышения со временем, то не исключено, что у пациентки проблемы с жизнеспособностью плода и плаценты.
Причины повышенного уровня прогестерона:
киста яичников,
патологическая беременность, а также пузырный занос или хорионкарцинома,
редкие формы опухолей яичников,
врождённая гиперплазия надпочечников.
Причины пониженного уровня прогестерона:
токсикоз на поздних сроках беременности,
пониженная функциональная активность яичников,
отсутствие менструаций,
внематочная беременность,
угроза выкидыша.
Что может влиять на результат?
Прием пищевых добавок и фармацевтических препаратов, меняющих концентрацию эстрадиола и прогестерона.
13. Эстрадиол (ESTRADIOL)
Эстрадиол относится к группе эстрогенных стероидных гормонов и является одним из наиболее распространенных и активных из них. Он играет важную роль в регуляции менструального цикла и функционировании женской половой системы.
Эстрадиол отвечает за развитие женских половых органов и вторичных половых признаков и влияет на менструальный цикл и беременность. Он считается основным половым гормоном у женщин и присутствует в небольших количествах у мужчин. Это один из основных эстрогенов у небеременных женщин.
Он производится в основном в яичниках, а также дополнительно в надпочечниках у женщин и в яичках и надпочечниках у мужчин.
У женщин в период менструального цикла уровень эстрадиола изменяется в течение месяца, поднимаясь и опускаясь согласованно со стимуляцией фолликулов в яичниках фолликулостимулирующим гормоном, лютеинизирующим гормоном и прогестероном, во время выхода яйцеклетки и готовности матки к потенциальной беременности. Уровень эстрадиола самый низкий в начале менструального цикла, а его подъем до самой высокой отметки как раз приходится на выпуск яйцеклетки из яичника (овуляцию). Нормальный уровень эстрадиола позволяет обеспечить надлежащую овуляцию, оплодотворение яйцеклетки и протекание беременности, а также здоровую структуру костей и нормальное содержание холестерина.
Что означают результаты?
Фаза цикла, беременность Эстрадиол, пг/мл
Женщины Фолликулиновая 12,4 — 233
Овуляторная 41 — 398
Лютеиновая 22,3 — 341
Постменопауза < 138
1-й триместр 154 — 3243
2-й триместр 1561 — 21280
3-й триместр 8525 — 30000
Мужчины 11,26 — 43,25
Необходимо внимательно относиться к интерпретации результатов, потому что концентрация эстрадиола меняется каждый день на протяжении менструального цикла. Врач, следящий за уровнем гормонов у женщины, должен учитывать тенденции его изменений, повышение или снижение в связи с менструальным циклом или беременностью, а не оценивать отдельные значения. Результаты анализа не являются специфичными, но дают врачу дополнительную информацию о возможной причине развития тех или иных симптомов у пациента.
Причины снижения уровня эстрадиола
Синдром Шерешевского – Тернера – хромосомная болезнь, сопровождающаяся аномалиями физического развития, низкорослостью и половым инфантилизмом.
Гипопитуитаризм (болезнь Симмондса, синдром Шиена) – снижение концентрации циркулирующих гипофизарных гормонов с последующим развитием гипофункции и атрофии надпочечников, щитовидной и половых желез.
Гипогонадизм – это снижение функции яичников из-за их врождённого недоразвития или повреждения во младенчестве.
Нервная анорексия, проявляющаяся у женщин аменореей.
Синдром поликистозных яичников (синдром Штейна – Левенталя) – полиэндокринный синдром, сопровождающийся нарушениями функции яичников (отсутствием или нерегулярностью овуляции, повышенной секрецией андрогенов и эстрогенов), поджелудочной железы, коры надпочечников, гипоталамуса и гипофиза.
Экстремальные упражнения на выносливость.
Постменопауза.
Причины повышения уровня эстрадиола
Раннее половое созревание.
Гинекомастия – доброкачественное увеличение грудной железы у мужчин с гипертрофией жировой ткани.
Опухоли яичников, яичек или надпочечников.
Гипертиреоз – увеличение преобразования андрогенов в эстрогены в тканях и повышение уровня циркулирующего глобулина, связывающего половые гормоны, из-за чего возрастает соотношение эстрогенов к андрогенам.
Цирроз печени.
Что может влиять на результат?
Глюкокортикостероиды, ампициллин, эстрогенсодержащие препараты, фенотиазины, тетрациклины способны повышать уровень эстрадиола.
Употребление травы каскары саграды иногда приводит к ложнозавышенным результатам данного анализа.
Диета с высоким содержанием углеводов и низким содержанием жиров, как у вегетарианцев, может понизить уровень эстрадиола.
14. Эстрон (ESTRONE)
Эстро́н (Е1) — женский половой гормон, второй по значению после эстрадиола, эстроген. Вырабатывается фолликулярным аппаратом яичников у женщин.
Небольшие количества эстрона вырабатываются также корой надпочечников у обоих полов и яичками у мужчин. По химическому строению эстрон является стероидным гормоном.
Эстрон синтезируется из андростендиона и производных прогестерона. Превращение заключается в деметилировании C19 и восстановления ароматичности А-цикла. Реакция подобна превращению тестостерона в эстрадиол
Эстрон способен конвертироваться в печени и в периферических тканях в эстрадиол и наоборот. Эстрон менее активен, чем эстрадиол, в 4—5 раз. Имеются предположения о том, что физиологическая роль эстрадиола и эстрона может быть различной, в связи с тем, что они неодинаково связываются с эстрогенными рецепторами подтипов E1 и E2.
15. Общий тестостерон (TOTAL TESTOSTERON)
Тестостерон общий – это половой гормон, продуцируемый у мужчин клетками Лейдига в яичках. У женщин источником синтеза стероидов служат яичники и кора надпочечников. Дегидроэпиандростерон (ДГЭА-С), продуцируемый корой надпочечников, яичками и яичниками служит предшественником тестостерона. Уровень тестостерона в крови у мужчин существенно превосходи уровень тестостерона у женщин. Тестостерон в крови у мужчин и женщин циркулирует в связи с белками. Большая часть его связана с ГСПГ- глобулином, связывающим половые гормоны, меньшая часть – с альбумином. Но физиологически активна не связанная с белками фракция гормона – свободный тестостерон.
У женщин анализ на тестостерон общий назначают при обследование по поводу бесплодия, гирсутизме (повышенном оволосении), нарушениях менструального цикла, невынашивании беременности, синдроме поликистозных яичников, опухолях яичников.
Что означают результаты теста?
Низкий уровень общего тестостерона у мужчин, полученный в двух разных исследованиях может быть лабораторным подтверждением гипогонадизма. При наличии признаков недостатка тестостерона и при нормальном уровне общего тестостерона в крови целесообразно определить уровень биологически активного свободного тестостерона. Также обычно с анализом на тестостерон у мужчин определяют уровень ЛГ для дифференциальной диагностики первичного и вторичного гипогонадизма, а также для выявления снижения тестостерона, связанного с возрастом (андропауза). Анализ на сывороточный уровень ЛГ, как и тестостерона, должен выполняться двукратно.
У женщин максимальная концентрация тестостерона определяется в лютеиновой фазе менструального цикла и в период овуляции. У беременных женщин концентрация тестостерона нарастает к III триместру в 3 — 4 раза превышая концентрацию у небеременных. В период менопаузы концентрация тестостерона снижается.
16. Свободный тестостерон (FREE TESTOSTERON)
Тестостерон – стероидный гормон из группы андрогенов (мужских половых гормонов). У мужчин вырабатывается клетками Лейдига в яичках и в небольшом количестве в коре надпочечников, у женщин — в яичниках и надпочечниках. Основными функциями тестостерона являются контроль над правильным развитием мужских половых органов, увеличение объема скелетных мышц, стимуляция сперматогенеза, роста волос на кожных покровах в области лица, подмышечных впадин, лобка. Секреция гормона меняется с возрастом – нарастает до 30 лет, а после 50 начинает снижаться. Также отмечаются и суточные колебания тестостерона: пик между 4 и 8 часами утра и минимум между 16 и 20 часами вечера.
При избыточном образовании андрогенов у женщин возникает вирилизация (вторичные половые признаки, характерные для мужчин), гирсутизм (чрезмерное оволосение по мужскому типу), огрубение голоса, гипертрофия клитора. Так как тестостерон стимулирует функцию сальных желез, его повышение часто связывают с развитием угревой сыпи. Сниженный синтез тестостерона у мужчин ведет к гипогонадизму (недоразвитию половых желез), оволосению по женскому типу, слабому развитию скелетной мускулатуры, недоразвитию наружных половых органов, бесплодию, увеличению молочных желез, ожирению. Недостаточная продукция данного андрогена у пожилых мужчин увеличивает риск остеопороза.
Общий тестостерон крови делится на 3 вида: тестостерон свободный (не связанный с белком, 1-4 % от общего), тестостерон, соединенный с глобулином, связывающим половые гормоны (60-70 %), и тестостерон, связанный с альбумином (слабосвязанный тестостерон, 25-40 %). Свободная и слабосвязанная формы – это биодоступный тестостерон, то есть обладающий биологической активностью. Связанный тестостерон, в свою очередь, не является активным.
Уровень свободного тестостерона не зависит от изменений концентрации глобулина, связывающего половые гормоны (ГСПГ). Поэтому, если ГСПГ повышен (при гипертиреоидизме, циррозе, приеме пероральных контрацептивов и противоэпилептических средств, гиперэстрогенных состояниях, в том числе беременности) или снижен (при гипотиреоидизме, ожирении, избытке андрогенов, нефритическом синдроме), тест на свободный тестостерон будет более информативным, чем на общий.
Причины повышения уровня тестостерона свободного
У мужчин:
опухоли яичек и надпочечников,
врождённая гиперплазия и дисфункция коры надпочечников (сопровождает дефицит ферментов 21- или 11-гидроксилазы),
раннее половое созревание у мальчиков,
синдром Иценко – Кушинга,
синдром Рейфенштейна.
У женщин:
синдром поликистозных яичников,
опухоль яичников, эндометрия и надпочечников,
адреногенитальный синдром (врождённая гиперплазия коры надпочечников),
синдром Иценко – Кушинга.
Причины понижения уровня тестостерона свободного
У мужчин:
генетические нарушения полового развития и производства тестостерона (синдром Клайнфелтера, синдром Прадера – Вилли),
патология гипоталамо-гипофизарной системы, связанная с продукцией лютеинизирующего гормона,
патология яичек (крипторхизм, миотоническая дистрофия),
приобретенная патология половых желез (из-за травмы яичек, при вирусном паротите, лучевом поражении или токсическом воздействии этанола при алкоголизме),
прием аналогов гонадолиберинов или антиандрогенов,
пожилой возраст.
У женщин снижение свободного тестостерона в клинической практике не принимают во внимание.
Что может влиять на результат?
Лекарственные препараты, повышающие уровень тестостерона: противосудорожные средства, барбитураты, бромокриптин, кломифен, даназол, эстрогены, миноксидил, правастатин, рифампицин, тамоксифен, бикалютамид, касодекс, циметидин, финастерид, люпрон, нилютамид, анаболические стероиды, гозерелин, левоноргестрел, нафарелин, налоксон, мифепристон, пероральные контрацептивы, фенитоин, вальпроевая кислота.
Лекарственные препараты, понижающие уровень тестостерона: антиандрогены, карбамазепин, кортикостероиды, циклофосфамид, дигоксин, эстрадиола валерат, фолликулостимулирующий гормон, финастерид, гемфиброзил, интерлейкин, кетоконазол, леупролид, магнезия, наркотические препараты, нафарелин, станозолол, спиронолактон, тетрациклин, верапамил, ципротерон, диэтилстильбэстрол, глюкоза, этанол, галотан, метопролол, метирапон, фенотиазиды.
После физических нагрузок уровень тестостерона в крови увеличивается.
17. Гидроксипрогестерон (17-ОПГ) (17-hydroxyprogesterone)
Анализ определяет количество 17-гидроксипрогестерона (17-ОПГ) в крови. 17-гидроксипрогестерон является предшественником кортизола и используется организмом для его производства.
Кортизол – это гормон, вырабатывающийся надпочечниками, он участвует в расщеплении белков, глюкозы и жиров, в поддержании нормального кровяного давления и регулировании активности иммунной системы. Образование кортизола стимулируется адренокортикотропным гормоном (АКТГ), который производится гипофизом. Концентрация кортизола обычно колеблется в течение дня, при этом наблюдается пик уровня гормона в 8 утра с последующим понижением к вечеру. Кроме того, содержание кортизола в крови повышается при болезнях и стрессе.
Для образования кортизола требуется несколько специальных ферментов. При нехватке одного или нескольких из них или нарушении их функции образуется ненормальное количество кортизола и его предшественников, из-за чего 17-гидроксипрогестерон накапливается в крови. Надпочечники используют избыточное количество 17-гидроксипрогестерона, производя при этом много андрогенов. Избыточные андрогены, в свою очередь, могут вызывать маскулинизацию, способствовать развитию мужских половых признаков не только у мужчин, но и у женщин.
Итак, наследственный дефицит специальных ферментов и, как результат, чрезмерное количество андрогенов приводят к целой группе функциональных нарушений в организме, известных под общим названием «гиперплазия надпочечников». Чаще всего она вызвана недостатком фермента 21-гидроксилазы, что является причиной заболевания в 90 % случаев. Гиперплазия надпочечников передается по наследству в легкой либо в тяжелой форме.
В более серьезных случаях врождённой гиперплазии надпочечников дефицит 21-гидроксилазы и избыточное количество андрогенов могут привести к тому, что ребенок женского пола появится на свет с невыраженными гениталиями – это затруднит определение пола у младенца. Мальчики же при таком заболевании выглядят нормальными при рождении, однако впоследствии половые признаки у них начинают развиваться преждевременно. У девочек вероятен гирсутизм сначала в детском возрасте и далее в период полового созревания, затем возникают нерегулярные менструации и появляются признаки маскулинизации. Почти у 75 % пациентов обоих полов, подверженных дефициту 21-гидроксилазы при врождённой гиперплазии надпочечников, производится меньше альдостерона – гормона, который регулирует удержание солей. Новорождённых детей обоих полов это может привести к угрожающему жизни «кризису потери солей»: у них в организме накапливается слишком много жидкости и поэтому слишком большое количество соли выводится с мочой. Бывает, что у пациентов с этими симптомами может быть пониженный уровень натрия в крови (гипонатриемия), повышенный уровень калия (гиперкалиемия), понижение альдостерона и повышенная активность ренина. Такая тяжелая, хотя и реже встречающаяся, форма заболевания часто обнаруживается при профилактическом медицинском осмотре новорождённых.
При более мягкой, наиболее распространенной, форме заболевания может наблюдаться только частичная недостаточность фермента. Иногда эта форма называется поздней, или неклассической, врождённой гиперплазией надпочечников – ее симптомы способны проявиться в любое время в детском возрасте, в период полового созревания либо у взрослых. При этом они могут быть слабовыраженными, возможно их медленное развитие со временем. И хотя такая форма гиперплазии надпочечников не представляет угрозу для жизни, она все же опасна проблемами с ростом, c развитием организма, а также аномальным половым созреванием у детей, что может стать причиной дальнейшего бесплодия.
У 75 % новорождённых с дефицитом 21-гидроксилазы, вызванным гиперплазией надпочечников, также производится меньше альдостерона – гормона, который регулирует удержание соли в клетках. Потеря слишком большого количества жидкости и солей вместе с мочой грозит острой недостаточностью функции коры надпочечников и так называемым кризисом потери солей.
Причины повышения уровня 17-ОПГ
Нормальные показатели 17-гидроксипрогестерона говорят об отсутствии врождённой гиперплазии надпочечников из-за дефицита 21-гидроксилазы.
Значительно повышенная концентрация 17-гидроксипрогестерона у новорождённого с большой вероятностью указывает на наличие у него врождённой гиперплазии надпочечников.
Умеренно повышенный уровень данного фермента может означать менее тяжелую форму гиперплазии надпочечников, также вероятен дефицит 11-бета-гидроксилазы (еще один фермент, дефект которого ассоциируется с врождённой гиперплазией надпочечников).
Причины понижения уровня 17-ОПГ
Низкие или понижающиеся уровни концентрации у пациентов с диагностированной гиперплазией свидетельствуют о положительном эффекте лечения.
Что может влиять на результат?
У преждевременно рождённых детей часто наблюдается повышенное содержание 17-гидроксипрогестерона.
18. Дегидроэпиандростерон-сульфат (ДЭА-SO4)(DHEA sulfate)
Дегидроэпиандростерон-сульфат – это мужской половой гормон (андроген), который содержится в крови как мужчин, так и женщин. Он участвует в формировании мужских вторичных половых признаков во время полового созревания и может быть преобразован организмом в более действенные андрогены (тестостерон и андростендион), а также конвертирован в женский гормон эстроген. Выработка ДЭА-SO4 контролируется питуитарным адренокортикотропным гормоном (АКТГ), а также другими питуитарными факторами.
Дегидроэпиандростерон-сульфат является информативным маркером функции надпочечников. Опухоли и рак надопочечников, а также их гиперплазия могут привести к избыточному производству ДЭА-SO4. У мужчин повышение уровня этого андрогена иногда остается незамеченным, в то время как для женщин оно опасно аменореей и маскулинизацией.
Избыточное производство ДЭА-SO4 у детей способствует преждевременному половому созреванию у мальчиков и неоднозначным наружным половым органам, повышенному оволосению тела и аномальным менструальным циклам у девочек.
Что означают результаты?
Пол Возраст Референсные значения
Женщины 10-15 лет 33,9 — 280 мкг/дл
15-20 лет 65,1 — 368 мкг/дл
20-25 лет 148 — 407 мкг/дл
25-35 лет 98,8 — 340 мкг/дл
35-45 лет 60,9 — 337 мкг/дл
45-55 лет 35,4 — 256 мкг/дл
55-65 лет 18,9 — 205 мкг/дл
65-75 лет 9,4 — 246 мкг/дл
> 75 лет 12 — 154 мкг/дл
Мужчины 10-15 лет 24,4 — 247 мкг/дл
15-20 лет 70,2 — 492 мкг/дл
20-25 лет 211 — 492 мкг/дл
25-35 лет 160 — 449 мкг/дл
35-45 лет 88,9 — 427 мкг/дл
45-55 лет 44,3 — 331 мкг/дл
55-65 лет 51,7 — 295 мкг/дл
65-75 ле 33,6 — 249 мкг/дл
> 75 лет 16,2 — 123 мкг/дл
Приемлемые уровни ДЭА-SO4 и других андрогенов могут свидетельствовать о нормальном функционировании надпочечников. Гораздо реже количество ДЭА-SO4 бывает в норме при опухоли надпочечника, но при этом не происходит секретирования гормона. При синдроме поликистозных яичников уровень ДЭА-SO4 может быть как повышенным, так и нормальным, поскольку это заболевание обычно связано с производством андрогенов яичниками (главным образом тестостерона).
Повышенный уровень ДЭА-SO4 может свидетельствовать об опухоли коры надпочечников, раке либо гиперплазии надпочечников. Он не является диагностическим признаком какой-то определенной болезни, однако указывает на необходимость дальнейшего обследования для выявления причин гормонального дисбаланса.
Низкий уровень ДЭА-SO4 бывает вызван дисфункцией надпочечников или гипопитуитаризмом, нарушениями, являющимися причиной понижения уровня питуитарных гормонов, которые, в свою очередь, регулируют производство и секрецию гормонов, производимых надпочечниками.
Что может влиять на результат?
У новорождённых детей уровень ДЭА-SO4 обычно высокий. Он резко падает после рождения и затем возрастает при половом созревании. Пика концентрация ДЭА-SO4 достигает после полового созревания, затем она уменьшается с возрастом.
Прием дегидроэпиандростерон-сульфатных добавок приводит к повышенному содержанию этого гормона в крови.
19. Иммуноглобулины IgA, IgM, IgG
Иммуноглобулины (Ig) или антитела — это особый вид белков, которые вырабатываются под влиянием антигенов и обладают способностью специфически связываться с ними. Иммуноглобулины по своему строению и функции делятся на 4 вида: Ig A, Ig M, Ig G, Ig E. Ig A — синтезируется В-лимфоцитами и составляет 10-15% всех видов иммуглобулинов.
Ig A является преобладающим иммуноглобулином секретов. Основной функцией его является защита слизистых оболочек дыхательных, мочеполовых путей и желудочно-кишечного тракта от инфекций.
Повышение уровня Ig A наблюдается при:
-хронических гнойных инфекциях, особенно желудочно-кишечного тракта и дыхательных путей (астма, туберкулез),
-аутоиммунных заболеваниях,
-хронических поражениях печени,
-множественной миеломе (Ig A тип),
-энтеропатиях, -алкоголизме, -муковисцидозе,
-многоклональная гаммапатия,
-Синдром Вискотта-Олдриджа.
Приобретенные факторы снижения уровня Ig A:
Новообразования лимфатической системы,
лимфопролиферативные заболевания,
состояние после спленэктомии,
потери белков при энтеро- и нефропатиях,
атопический дерматит,
злокачественные анемии,
гемоглобинопатии,
лечение иммунодепрессантами и цитостатиками,
облучение ионизирующей радиацией,
длительный контакт с бензолом, толуолом, ксилолом,
прием декстрана, метилпреднизолона, эстрогенов, карбамазепина, вальпроевой кислоты, препаратов золота.
Врожденные факторы снижения уровня Ig A:
агаммаглобулинемия (болезнь Брутона),
атаксия-телеангиоэктазия (синдром Луи-Бар)
Ig М – синтезируется В-лимфоцитами и составляет 5-10% от общего количества иммуноглобулинов. Образуется на ранних стадиях инфекционного процесса (до 5 суток), активирует фагоцитоз и фракции комплемента, нейтрализует вирусы и агглютинирует бактерии.
Повышение уровня Ig М наблюдается при:
-острых и хронических гнойных инфекциях, особенно желудочно-кишечного тракта и дыхательных путей,
-коллагенозах,
-острых и хронических поражениях печени,
-энтеропатиях,
-паразитарных заболеваниях,
-множественных миеломах (Ig М тип),
-лечении хлорпромазином, -макроглобулинемии Вальденстрема,
-моноклональной Ig М гаммапатии,
-наличии холодовых агглютининов.
Приобретенные факторы снижения уровня Ig М:
состояние после спленэктомии,
потери белков при энтеро- и нефропатиях,
лечение иммунодепрессантами и цитостатиками,
облучение ионизирующей радиацией, лимфома,
прием декстрана, препаратов золота.
Врожденные факторы понижения уровня Ig M:
агаммаглобулинемия (болезнь Брутона),
моноклональные (не Ig М) гаммапатии,
селективный дефицит иммуноглобулина Ig М.
Ig G – вырабатываются В-лимфоцитами и составляют 75% всех иммуноглобулинов сыворотки. Ig G играет основную роль в формировании длительного гуморального иммунитета после перенесенных инфекционных заболеваний. Основной механизм: формирование комплексов «антиген-антитело». Проникает через плаценту и защищает плод и новорожденного до 9 месяцев.
Повышение уровня Ig G наблюдается при:
-хронических гнойных инфекциях (туберкулез, инфекционный мононуклеоз др.),
-аутоиммунных заболеваниях,
-хронических поражениях печени (степень повышения уровня коррелирует с тяжестью поражения печени), —
ВИЧ- инфекции,
-паразитарных инвазиях,
-муковисцидозе,
-саркоидозе,
-моноклональной Ig G гаммапатии,
-множественной миеломе (Ig G- тип),
-хроническм гранулематозе.
Приобретенные факторы снижения уровня Ig G:
состояние после спленэктомии,
потери белков при энтеро- и нефропатиях,
лечение иммунодепрессантами и цитостатиками,
облучение ионизирующей радиацией,
лимфопролиферативные заболевания,
атопический дерматит и другие аллергические заболевания,
ВИЧ-инфекция,
наследственная мышечная дистрофия,
транзиторная гипогаммаглобулинемия или медленный иммунологический старт у грудных детей,
прием декстрана, препаратов золота.
Врожденные факторы понижения уровня Ig G:
агаммаглобулинемия (болезнь Брутона).
20. Фолликулостимулирующий гормон (ФСГ) (FSH)
Фолликулостимулирующий гормон (ФСГ) совместно с лютеинизирующим гормоном (ЛГ) вырабатывается в передней доле гипофиза под воздействием гипоталамического гонадотропин-либерирующего гормона. Секреция ФСГ происходит в импульсном режиме с интервалами в 1-4 часа. Во время выброса длительностью около 15 минут концентрация ФСГ превышает средний показатель в 1,5-2,5 раза и регулируется уровнем половых гормонов по принципу отрицательной обратной связи. Низкие уровни половых гормонов стимулируют выделение ФСГ в кровь, а высокие – угнетают. Подавляет производство ФСГ также белок ингибин В, синтезирующийся в клетках яичников у женщин и клетках, выстилающих семенные канальцы (клетки Сертоли), у мужчин.
У детей уровень ФСГ кратковременно увеличивается после рождения и очень сильно падает в 6 месяцев у мальчиков и в 1-2 года у девочек. Затем уже он повышается перед началом полового созревания и возникновением вторичных половых признаков. Одним из первых лабораторных показателей начала периода пубертата (полового созревания) у детей является увеличение концентрации ФСГ ночью. Вместе с этим усиливается ответ половых желез и повышается уровень половых гормонов.
У женщин ФСГ стимулирует созревание фолликулов яичников, готовит их к воздействию лютеинизирующего гормона и усиливает высвобождение эстрогенов. Менструальный цикл состоит из фолликулиновой и лютеиновой фаз. Первая фаза цикла проходит под воздействием ФСГ: фолликул увеличивается и вырабатывает эстрадиол, а в конце резкое повышение уровней фолликулостимулирующего и лютеинизирующего гормонов провоцирует овуляцию – разрыв созревшего фолликула и выход яйцеклетки. Затем наступает лютеиновая фаза, во время которой ФСГ способствует выработке прогестерона. Эстрадиол и прогестерон по принципу обратной связи регулируют синтез ФСГ гипофизом. Во время менопаузы яичники прекращают функционировать и сниженная секреция эстрадиола приводит к увеличению концентраций фолликулостимулирующего и лютеинизирующего гормонов.
У мужчин ФСГ влияет на развитие семенных канальцев, увеличивает концентрацию тестостерона, стимулирует образование и созревание спермы в яичках и способствует продукции андрогенсвязывающего белка. После полового созревания уровень ФСГ у мужчин относительно постоянный. К увеличению его количества приводит первичная недостаточность яичек.
Анализ на гонадотропные гормоны позволяет определить уровень нарушений гормональной регуляции – первичный (зависимый от самих половых желез) или вторичный (связанный с гипоталамо-гипофизарной осью). У пациентов с расстройством функции яичек (или яичников) низкие показатели ФСГ свидетельствуют о дисфункции гипоталамуса или гипофиза. Повышение же ФСГ указывает на первичную патологию половых желез.
Одновременное проведение тестов на фолликулостимулирующий и лютеинизирующий гормоны используется для диагностики мужского и женского бесплодия и определения тактики лечения.
Что означают результаты?
Пол Фаза цикла Референсные значения
Мужской 1,5 — 12,4 мМЕ/мл
Женский Менструальная (1-6-й день) 3,5 — 12,5 мМЕ/мл
Фолликулиновая (пролиферативная) (3-14-й день) 3,5 — 12,5 мМЕ/мл
Овуляторная (13-15-й день) 4,7 — 21,5 мМЕ/мл
Лютеиновая (15-й день – начало менструации) 1,7 — 7,7 мМЕ/мл
Постменопауза 25,8 — 134,8 мМЕ/мл
Пременопауза 1,7 — 21,5 мМЕ/мл
Менопауза. Причины повышения уровня ФСГ
Первичная недостаточность яичников (синдром преждевременного истощения яичников, синдром дискенезии яичников, опухоли и кисты яичников, синдром Шерешевского – Тернера, синдром Суайра, недостаточное производство стероидных гормонов яичниками – дефицит 17-альфа-гидроксилазы).
Первичная тестикулярная недостаточность у мужчин (аплазия или агенезия яичек, синдром Клайнфелтера, опухоли яичек).
Гипогонадизм вследствие воздействия на яичники или яички каких-либо внешних факторов (рентгеновских лучей, химиотерапии, алкоголя, инфекционных болезней, аутоиммунных заболеваний, травмы, кастрации).
Гиперфункция или опухоли гипофиза.
Эндометриоз.
Тестикулярная феминизация.
Эктопическая секреция при некоторых гормон-секретирующих новообразованиях (чаще при опухоли легкого).
Преждевременное половое созревание.
Алкоголизм.
Причины понижения уровня ФСГ в крови
Дефицит гипоталамического гонадолиберина (синдром Каллмана – врождённый вторичный гипогонадизм — расстройство импульсной секреции гонадолиберина в гипоталамусе).
Изолированный дефицит ФСГ.
Гипофизарная недостаточность.
Карликовость.
Синдром Шихана.
Гиперпролактинемия.
Новообразования яичников, яичек и надпочечников с повышенной секрецией эстрогенов и андрогенов.
Синдром поликистозных яичников.
Гемохроматоз.
Анорексия и голодание.
Что может влиять на результат?
Неадекватные показатели уровня ФСГ возможны из-за приема пациентом радиоизотопных препаратов, пероральных гормональных препаратов, беременности, введения в организм гетерофильных антител (в том числе моноклональных), ядерно-магнитного резонансного сканирования пациента, проведенного незадолго до исследования на ФСГ, курения и употребления алкоголя.
Лекарственные препараты и вещества, повышающие уровень ФСГ в крови: бикалутамид, бромокриптин, циметидин, кломифен, даназол, дигиталис, эритропоэтин, финастерид, аналоги гонадолиберина, соматолиберин, гидрокортизон, кетоконазол, леупролид, леводопа, метформин, налоксон, нилютамид, фенитоин, правастатин, тамоксифен.
Лекарственные препараты и вещества, снижающие уровень ФСГ в крови: анаболические стероиды, противосудорожные, карбамазепин, конъюгированные эстрогены, кортиколиберин, даназол, диэтилстильбэстрол, эстроген- и прогестеронсодержащие препараты, финастерил, госерелин, медроксипрогестерон, мегестрол, октреотид, пероральные контрацептивы, фенотиазиды, пимозид, преднизолон, станозолол, торемифен, вальпроевая кислота.
Важные замечания
У женщин тест на ФСГ должен проводиться с учетом дня менструального цикла. Концентрация ФСГ достигает пика во время овуляции, так что анализ обычно сдают на 6-7-й день цикла или в соответствии с указаниями лечащего врача.
При пониженном ФСГ необходимо сдать кровь еще раз, поскольку выделение гормона из гипофиза носит импульсный характер и разовое тестирование может не отразить действительной активности гормональной регуляции. В то же время при состояниях, связанных с повышением ФСГ, однократное взятие пробы считается достаточным.
Пациенты, получающие биотин в высоких дозах (> 5 мг/сут.), могут сдавать анализ, только если после приема препарата прошло больше восьми часов.
Уровень ФСГ повышается с возрастом.
СПЕЦИАЛЬНЫЙ АНАЛИЗ КРОВИ
21. Афлатоксин (Aflatoxin group)
Афлатоксинами называют ядовитые вещества, которые выделяют плесневые грибки рода Аспергилл. Грибковые споры попадают в продукты питания, при употреблении которых человек получает серьезное отравление. Выделяют четыре группы основных видов афлатоксинов – В1, В2, G1, G2. Токсины обладают высокой устойчивостью, не разрушаются при воздействии высокой температуры. Афлатоксикозом называют пищевое отравление, возникающее в результате употребления продуктов питания, зараженных афлатоксинами.
Наиболее опасным и распространенным считается афлатоксин В1. Он встречается в разных крупах, чае, орехах, особенно в арахисе. Не менее опасно производное соединение М1, часто присутствующее в мясных продуктах и молоке. При употреблении подобной пищи происходит проникновение афлатоксинов в организм человека и его заражение. Продукты: Любые виды орехов, Сухофрукты, Чайные и кофейные упаковки, Молочная продукция, Разные специи, Хлебные изделия, Мясо, Детское питание. Распространяются афлатоксины в пищевых продуктах при наличии благоприятных условий. Если в помещении повышенная влажность и нет хорошей вентиляции, то вероятность появления токсических веществ на продуктах питания очень высокая. Нарушенные упаковки с едой также становятся местом появления афлатоксинов.
Продукты питания с истекшими сроками годности не рекомендуется употреблять, особенно если визуально заметно наличие плесени. Избавиться от афлатоксинов при помощи термической обработки нельзя, поэтому продукт просто уничтожают.
В легких формах отравления действие на организм менее выражено. У человека ослабевает иммунная система, у детей замедляется рост. Афлатоксины нарушают обмен веществ и минералов, негативно влияют на состояние костей, сбивают процесс всасывания жиров. Смертельная дозировка 75 мкг на один кг массы тела. Летальный исход развивается спустя два дня, человек умирает от недостаточности печени.
22. Охратоксин А (Ochratoxin A)
Охратоксин А — органическое соединение, производное кумарина, микотоксин из группы охратоксинов, продуцируемый микроскопическими плесневыми грибами рода Аспергилл (Aspergillus ochraceus, Aspergillus carbonarius и др.) и рода Пеницилл (Penicillium verrucosum и др.). Является контаминантом (пищевым загрязнителем), тем самым представляет серьёзную угрозу для здоровья и жизни человека. Чрезвычайно токсичен, нейротоксин, потенциальный канцероген для человека (группа 2B)[1], мутаген, тератоген и к тому же обладает сильной нефро- и гепатоксичностью, иммуносупрессор, вызывает иммунодефицитные состояния.
Существует риск для здоровья человека не только за счет потребления загрязненных продуктов растительного происхождения, но и продуктов из животного происхождения. Охраротоксин А был определен в крови и почках свиней, а также в крови человека и материнском молоке.
23. Трихотеценовые микотоксины (Trichothecenes Group)
Трихотеценовые микотоксины или просто трихотецены (сокр. ТТМТ) — органические соединения из так называемого семейства сесквитерпеноидов. В настоящее время идентифицировано более 100 трихотеценов, большинство из них являются слаботоксичными, лишь немногие — смертельно опасны. Трихотеценовые микотоксины — вторичные метаболиты, которые продуцируются в основном микроскопическими плесневыми грибами (микромицетами) рода Fusarium, а также в меньшей степени Stahybotrys, Trichoderma, Cephalosporium, Trichothecium и Mizothecium.
Контаминанты, являются сильными иммунодепрессантами, поражают органы кроветворения, ЖКТ, повышают риск возникновения геморрагий (кровоизлияний) внутренних органов человека.
Источниками ТТМТ являются пищевые продукты, корма для животных, а также сырьё из которого они производятся, поражённые в основном микромицетами рода Фузариум. Контаминация происходит в основном при несоблюдении санитарно-гигиенических правил и технологических требований к подготовке и хранения сырья для производства пищевой продукции и кормов.
В большинстве случаев трихотеценами загрязнены зерновые культуры (кукуруза, пшеница, овёс, ячмень), а также масличные и бобовые культуры (арахис).
24. Инсулиноподобный фактор роста (IGF 1)
Результат теста на инсулиноподобный фактор роста (ИФР) является косвенным показателем количества гормона роста (ГР), вырабатываемого организмом. ИФР и ГР – это полипептидные гормоны, то есть небольшие белковые молекулы, которые необходимы для нормального роста и развития костей и тканей организма. ГР производится гипофизом, небольшой железой, расположенной в основании головного мозга на уровне переносицы. Он секретируется в кровяной поток волнообразно в течение суток, достигая максимального уровня, как правило, в ночное время. ИФР синтезируется печенью и скелетными мышцами, а также многими другими тканями в ответ на их стимуляцию гормоном роста. ИФР важен для многих функций гормона роста, стимулирует рост костей и других тканей организма, а также способствует увеличению мышечной массы. Он отражает избыток и недостаток гормона роста.
Концентрация ИФР, как и концентрация ГР, очень невысока в раннем детстве, затем она повышается, достигая пика в период полового созревания, а у взрослых понижается.
Дефицит ИФР и ГР может быть обусловлен, например, гипопитуитаризмом либо опухолью гипофиза, которая, повреждая клетки, продуцирующие гормон, препятствует его синтезу. Нехватка ИФР наблюдается также при отсутствии чувствительности к ГР, которое может быть вызвано недоеданием, гипотиреозом, недостатком половых гормонов и некоторыми хроническими заболеваниями. Генетическая нечувствительность к ГР (ГР-резистентность) встречается очень редко.
Дефицит ГР в раннем детстве может мешать росту и развитию ребенка. У взрослых недостаток гормона способен приводить к снижению плотности костной ткани, недоразвитию мышц и изменению состава липидов. Тем не менее анализ на ГР или на ИФР, как правило, не назначают взрослым, у которых пониженная плотность костей, атрофия мышц либо недостаток липидов – лишь в очень редких случаях нехватка ГР и, как следствие, дефицит ИФР являются причиной этих расстройств.
Избыток ГР и ИФР может способствовать аномальному формированию скелета, а также другим проявлениям гигантизма и акромегалии. При гигантизме у детей происходит чрезмерный рост костей, что является причиной очень высокого роста, а также увеличения рук и ног до ненормально больших размеров. У взрослых акромегалия вызывает утолщение костей и мягких тканей, например разрастание тканей носа. В итоге следствием избытка ГР может быть увеличение внутренних органов, например сердца, а также диабет второго типа, сердечно-сосудистые заболевания, в частности гипертония, артриты и уменьшение продолжительности жизни.
Наиболее распространенная причина повышенной секреции гормона роста – опухоль гипофиза (обычно доброкачественная). Как правило, она может быть удалена хирургическим путем или вылечена при помощи лекарств либо химиотерапии. В большинстве случаев это приводит к нормализации ГР и ИФР.
25. Протеин, связывающий инсулиноподобный фактор роста 3 (S-IGFBP-3)(IGF BP3)
IGFBP-3 – это пептид, участвующий в регуляции роста клеток. Более 95% имеющегося в сыворотке крови IGF-1 связано с белками-носителями, которые подразделяются на 6 классов. Наиболее важный из них – белок-носитель IGFBP-3. Он связывает одинаковой аффинностью как IGF-1, так и IGF-2. Основной гормон, регулирующий синтез IGFBP-3 – это гормон роста (GH). В отличие от гормона роста, который высвобождается эпизодически и чье содержание в крови значительно колеблется в течение суток, количество IGFBP-3 стабильно и для его определения не надо проводить тест-нагрузку
Содержание IGFBP-3 увеличено у детей и у подростков пубертатного возраста (наибольшее содержание у 14-16-летних), по достижении совершеннолетия начинает понемногу снижаться. Кроме возраста, влияют также на его содержание половое развитие, питание, а также функция печени и почек.
Референтные значения:
Зависят от возраста и пола, поэтому для правильной интерпретации необходимо указывать на направлении пол и возраст пациента.
0-2 г 0,7-3,9 μg/mL
3-4 л 0,9-4,7 μg/mL
5-6 л 1,2-5,5 μg/mL
7 л 1,4-6,1 μg/mL
8 л 1,6-6,5 μg/mL
9 л 1,8-7,1 μg/mL
10 л 2,1-7,7 μg/mL
11 л 2,4-8,4 μg/mL
12 л 2,7-8,9 μg/mL
13-16 л 3,0-10,0 μg/mL
17 л 3,2-8,7 μg/mL
18-30 л 3,0-7,9 μg/mL
31-60 л 3,3-7,0 μg/mL
61-75 л 2,8-6,6 μg/mL
>76 л 2,2-5,0 μg/mL
Низкие значения IGFBP-3, которые не были обусловлены дефицитом гормона роста:
Недоедание и длительный пост
Печеночная недостаточность
Диабет
Высокие значения GFBP-3:
Хроническая почечная недостаточность
26. Аллерген f79 — клейковина (глютен), IgG(Allergen Gluten IgG)
Глютен, или клейковина, объединяет группу белков, являющихся составной частью семян злаковых растений, таких как пшеница, рожь, ячмень и овес. Как этиологический фактор пищевой аллергии он имеет высокую степень аллергизирующей активности (без учета индивидуальных особенностей). Максимальное количество клейковины содержится в пшенице (до 80 %). Пшеничная мука и ее компоненты (соответственно, и глютен) часто используются как связующий элемент и стабилизатор в колбасах и сосисках, мясных и рыбных консервах, молочных продуктах (йогуртах, творожках, сырках), майонезах, кетчупах, соусах, крабовых палочках, продуктах быстрого приготовления, бульонных кубиках, растворимом кофе, даже в кукурузных хлопьях, поэтому при непереносимости глютена возможны реакции и при их употреблении. Часто наблюдается перекрестная аллергия к пыльце злаковых трав (пырея ползучего, тимофеевки луговой, ковыля и др.).
Аллергия на глютен, как правило, сопровождается нарушением функции пищеварительной системы (хейлит, гастрит, колит, гастроэнтерит, синдром раздраженной кишки), кожными проявлениями (атопический дерматит, крапивница, отек Квинке) и реже нарушениями функции дыхательной системы и системными проявлениями, такими как анафилактический шок.
IgG может быть причиной аллергической реакции немедленного или замедленного типа, пищевой непереносимости или других необычных ответов организма на прием пищи. Чаще всего это проявляется после длительного поступления аллергена с едой.
Значение выявления IgG-антител к пищевым аллергенам остается неоднозначным, так как положительный результат может быть вариантом нормы, поэтому важно в комплексе оценивать результаты всех исследований, данные пищевого дневника и анамнез заболевания.
Иммуноглобулины класса G могут служить маркером развития толерантности к пищевым аллергенам. Тестирование на IgG-антитела целесообразно проводить в комплексе с другими исследованиями или в трудных случаях диагностики пищевой непереносимости, когда исключены другие возможные причины появления симптомов аллергии. Возможно использование результатов теста для индивидуального подбора наиболее рациональной диеты, для отслеживания формирования пищевой толерантности.
Что означают результаты?
Референсные значения: 0 — 10 мг/л.
Причины положительного результата:
реакции непереносимости на глютен, глютен воспринимается как пищевой аллерген (когда исключены другие возможные причины появления симптомов аллергии);
вариант нормы — выявленные IgG могут выполнять функции блокирующих антител, которые уменьшают выраженность аллергических реакций, протекающих с участием специфических IgE.
Важные замечания
Выполнение данного исследования безопасно для пациента по сравнению с кожными тестами (in vivo), так как исключает контакт пациента с аллергеном. Прием антигистаминных препаратов и возрастные особенности не влияют на качество и точность исследования.
27.Целиакия. Скрининг ( CELIAC DISEASE PANEL)
Глютеновая энтеропатия (целиакия) – это аутоиммунное заболевание, возникающее у предрасположенных лиц в ответ на поступление с пищей глютена. Глютен присутствует во многих продуктах питания, богатых злаковыми (ячмень, рожь и пшеница). Наибольшее значение в развитии аутоиммунного процесса имеет один из компонентов глютена – белок глиадин. Под воздействием фермента тканевой трансглутаминазы он превращается в более иммуногенный пептид, а также образует иммуногенные комплексы с данным ферментом. Поступление с пищей глютена провоцирует и поддерживает воспалительный процесс в слизистой оболочке кишки, который с течением времени приводит к ее атрофии. Наблюдаемые при этом морфологические и клинические признаки объединяют в понятие глютеновой энтеропатии.
При целиакии вырабатываются разнообразные антитела, в том числе антитела к глиадину, эндомизию, ферменту тканевой трансглутаминазе и другим компонентам. Определение их уровня применяется, соответственно, для диагностики глютеновой энтеропатии. Исследования, предназначенные для исключения глютеновой энтеропатии у пациентов без симптомов этого заболевания, называются скрининговыми. В качестве скрининговых тестов используются клинико-лабораторные маркеры, обладающие высокой чувствительностью по отношению к выявляемому заболеванию. Для скрининга глютеновой энтеропатии это комбинация следующих серологических тестов: исследование антител к тканевой трансглутаминазе IgA и суммарных иммуноглобулинов A (IgA) в сыворотке.
Суммарные антитела класса IgA являются важным фактором местной защиты слизистых оболочек. Они связываются с микроорганизмами и предотвращают их проникновение с внешних поверхностей вглубь тканей, усиливают фагоцитоз антигенов путем активации комплемента по альтернативному пути. Дефицит IgA нередко ассоциируется с аутоиммунными патологиями — энтеропатиями, сопровождающимися потерей белка.
Антитела к тканевой трансглутаминазе IgA и IgG направлены против фермента, участвующего в биохимических превращениях глиадина. Специфичность определения IgA-антител к тканевой трансглутаминазе в отношении целиакии выше, чем специфичность теста на IgG (97-99 % против 77-95 %).
Скрининговые методы используются для пациентов из групп риска по глютеновой энтеропатии:
1) пациенты с отягощенным наследственным анамнезом по глютеновой энтеропатии,
2) пациенты с аутоиммунными заболеваниями (сахарный диабет 1-го типа, аутоиммунный тиреоидит Хашимото, системные заболевания соединительной ткани),
3) пациенты с синдромом Дауна.
Следует помнить, что частота отдельного дефицита иммуноглобулина IgA выше среди больных глютеновой энтеропатией. В итоге результат исследования на IgA-антитела может быть ложноотрицательным у пациентов с сочетанием глютеновой энтеропатии и дефицита иммуноглобулина IgA.
28. Определение омега-3-индекса
Омега-3-ненасыщенные жирные кислоты являются незаменимыми веществами, неспособными синтезироваться в организме. Они обладают кардиопротективными, гиполипидемическими и антиаритмическими свойствами, принимают участие в делении и росте клеток, процессе пищеварения, свертывании крови, функционировании головного мозга и клеточного транспорта. К омега-3-жирным кислотам относятся альфа-линоленовая кислота (АЛК), эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК).
Научно доказано, что дефицит омега-3 в рационе ассоциирован с повышенным риском развития сердечно-сосудистых заболеваний, в том числе внезапной сердечной смерти. Лабораторным показателем недостаточности омега-3-кислот является омега-3-индекс. Он рассчитывается как сумма процентного содержания эйкозапентаеновой (ЭПК) и докозагексаеновой (ДГК) полиненасыщенных жирных кислот в мембране эритроцитов. Омега-3-индекс отражает риск развития сердечно-сосудистых заболеваний и их осложнений, особенно внезапной сердечной смерти.
Доказано, что употребление продуктов с повышенным содержанием омега-3-жирных кислот снижает риск сердечно-сосудистых осложнений, нормализует сердечный ритм, уменьшает уровень триглицеридов и холестерина в крови. Согласно исследованиям, при употреблении рыбы даже 1 раз в неделю риск ишемической болезни сердца снижается на 15 %, а более 5 раз в неделю – на 40 %. Концентрация омега-3-жирных кислот в крови прямо коррелирует с поступлением эйкозапентаеновой и докозагексаеновой с пищей. Главными пищевыми источниками ЭПК и ДГК являются жир некоторых видов рыб (например, лосося, тунца, семги, скумбрии, сельди) и бурые водоросли. В овощах с зелеными листьями, бобах, растительных маслах содержится альфа-линоленовая кислота, которая в процессе пищеварения в небольших количествах превращается в ЭПК и ДГК.
Таким образом, поддержание оптимального уровня ненасыщенных жирных кислот в крови – важный аспект профилактики атеросклероза, гипертонии, ишемической болезни сердца. Омега-3-индекс (процент содержания ЭПК+ДГК от общего количества жирных кислот в эритроцитах) можно рассматривать в качестве маркера и даже фактора риска ишемической болезни сердца, особенно фатальных аритмий.
Что означают результаты?
Референсные значения
< 4 % – высокий риск сердечно-сосудистых заболеваний;
4,1 — 7,9 % – средний риск;
> 8 % – низкий риск.
29. Комплексный анализ крови на ненасыщенные жирные кислоты семейства омега-6
Омега-6 – это эссенциальные (жизненно необходимые, незаменимые) нутриенты. Человеческий организм не способен самостоятельно синтезировать эти ЖК, основным источником их поступления является пища. Линолевая кислота – это основная омега-6-ЖК, поступающая с пищей, преимущественно с растительными маслами (подсолнечное, кукурузное, соевое и др.). Линолевая кислота затем может быть преобразована в другие ненасыщенные ЖК, например, γ-леноленовую кислоту или дигомо-γ-леноленовую кислоту, которые, в свою очередь, могут быть превращены в арахидоновую кислоту – хорошо известный предшественник многих метаболически активных соединений (простагландинов, тромбоксанов, лейкотриенов и др.). Арахидоновая кислота также относится к семейству омега-6. В многочисленных исследованиях доказано, что омега-6-ЖК обладают холестеринснижающим эффектом и снижают риск сердечно-сосудистых заболеваний.
Для оценки баланса омега-6-ЖК в организме и прогноза сердечно-сосудистых заболеваний проводят исследование концентрации этих нутриентов в крови. В настоящий момент нет единого мнения о том, в каком количестве рекомендуется употреблять омега-6-ЖК. Взрослому мужчине необходимо 17 г линолевой кислоты в день, а взрослой женщине – 12 г, что составляет около 5-6 % рекомендуемой калорийности суточного рациона. Не до конца понятно, какой эффект на организм оказывает избыток омега-6-ЖК. С одной стороны, есть данные о том, что диета с большим количеством омега-6-ЖК (11-21 % калорийности рациона) также снижает риск сердечно-сосудистых заболеваний и не представляет опасности для человека. С другой стороны, появляются данные о роли омега-6-ЖК в канцерогенезе. Так, например, была выявлена ассоциация между омега-6-ЖК и повышенным риском рака молочной железы. Этот канцерогенный эффект, по-видимому, зависит от генетических особенностей метаболизма омега-6-ЖК и проявляется только у небольшой части генетически предрасположенных людей. Тем не менее отношение к диете с повышенным содержанием омега-6-ЖК должно быть осторожным. Некоторые диетологи рекомендуют снизить процент омега-6-ЖК в рационе до 3 % и даже меньше.
Большое значение имеет не только количество ЖК в рационе, но и их соотношение. В течение длительного времени развития человека как вида соотношение омега-6/омега-3-ЖК составляло 2:1. После индустриальной революции состав рациона человека стремительно изменился: стали преобладать насыщенные жирные кислоты, а соотношение омега-6/омега-3-ЖК возросло до 20-30:1. По мнению многих экспертов, это изменение рациона играет огромную роль в возникновении эпидемии сердечно-сосудистых заболеваний в наше время. На основании этих представлений многие диетологи рекомендуют соблюдать диету с соотношением омега-6/омега-3-ЖК около 2:1, причем достигать этого соотношения не столько путем снижения омега-6, сколько путем увеличения омега-3 ЖК. Снижение соотношения омега-6/омега-3-ЖК хотя бы до 4:1 у больных с заболеваниями сердца ассоциировано со снижением общей смертности на 70 % (!).
Хотя концентрация омега-6 ЖК может дать полезную информацию о риске сердечно-сосудистых заболеваний, этот клинико-лабораторный параметр не входит в стандартные «калькуляторы» риска, такие как «Кардиопрогноз» и «Атероскрин оптимальный». Для получения более точной информации могут понадобиться дополнительные лабораторные исследования, в том числе оценка антиоксидантной системы организма и липидограмма.
Что означают результаты?
Референсные значения:
Линолевая 2270 — 3850 мкмоль/л
Гамма-линоленовая 16 — 150 мкмоль/л
Арахидоновая 520 — 1490 мкмоль/л
Дигомогамма-линоленовая 50 — 250 мкмоль/л
Эйкозадиеновая 7 — 22 мкмоль/л
Докозадиеновая 0 — 0,9 мкмоль/л
Докозатетраеновая 10 — 80 мкмоль/л
Причины повышения:
диета, богатая омега-6 жирными кислотами.
Причины понижения:
голодание;
мальабсорбция (хронический панкреатит, целиакия, состояние после оперативного удаления тонкой кишки).
Что может влиять на результат?
Диета;
физическая нагрузка.
Важные замечания
В настоящий момент нет единого мнения о том, в каком количестве рекомендуется употреблять омега-6-ЖК.